
| A. | 配制100 g 10% CuSO4溶液,称取10 g硫酸铜晶体溶于90 g水中 | |
| B. | 将30%的乙醇溶液和70%的乙醇溶液等体积混和后所得乙醇溶液的质量分数为50% | |
| C. | 配制一定物质的量浓度的稀硫酸溶液时,称量浓硫酸时仰视量筒的刻度线 | |
| D. | 质量分数为10%和90%的两种硫酸等质量混合配制50%的硫酸溶液 |
分析 A.100g10%CuSO4溶液中m(CuSO4)=100g×10%=10g,10g硫酸铜晶体中m(CuSO4)=10g×$\frac{160}{250}$=6.4g,配制溶液浓度=$\frac{6.4g}{10g+90g}×100%$;
B.乙醇溶液中质量分数越大其密度越小;
C.配制一定物质的量浓度的稀硫酸溶液时,称量浓硫酸时仰视量筒的刻度线,导致量取硫酸溶液体积偏大,溶液中溶质的物质的量偏大;
D.根据硫酸质量和质量分数计算出10%和90%的两种硫酸等质量混合后的质量分数.
解答 解:A.100g10%CuSO4溶液中m(CuSO4)=100g×10%=10g,10g硫酸铜晶体中m(CuSO4)=10g×$\frac{160}{250}$=6.4g,配制溶液浓度=$\frac{6.4g}{10g+90g}×100%$=6.4%,配制溶液浓度偏低,故A错误;
B.乙醇溶液中质量分数越大其密度越小,所以将30%的乙醇溶液和70%的乙醇溶液等体积混和后所得乙醇溶液的质量分数小于50%,故B错误;
C.配制一定物质的量浓度的稀硫酸溶液时,称量浓硫酸时仰视量筒的刻度线,导致量取硫酸溶液体积偏大,溶液中溶质的物质的量偏大,所以最终配制溶液浓度偏高,故C正确;
D.设质量为m,10%的硫酸溶液和90%的硫酸混合后,配制的硫酸的质量分数为:$\frac{10%m+90%m}{2m}$=50%,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及溶液配制、溶液浓度有关计算等知识点,侧重考查学生分析计算能力,易错选项是D,题目难度不大.


科目:高中化学 来源: 题型:解答题
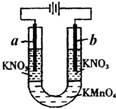 如图所示的实验可以证明KMnO4溶液的紫色是由于MnO4-离子存在的缘故,且不破坏MnO4-.U形管中加入KMnO4溶液,然后小心地在管端的两液面上加入KNO3溶液,将石墨电极插入KNO3溶液中,接通直流电源.
如图所示的实验可以证明KMnO4溶液的紫色是由于MnO4-离子存在的缘故,且不破坏MnO4-.U形管中加入KMnO4溶液,然后小心地在管端的两液面上加入KNO3溶液,将石墨电极插入KNO3溶液中,接通直流电源.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
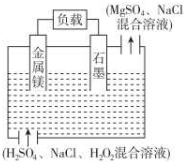 镁-过氧化氢电池是一种新型的高性能电源,其结构如图所示,下列说法不正确的是( )
镁-过氧化氢电池是一种新型的高性能电源,其结构如图所示,下列说法不正确的是( )| A. | 镁作该电源负极,发生反应Mg-2e-═Mg2+ | |
| B. | 该电池反应方程式:Mg+H2O2+2H+═Mg2++2H2O | |
| C. | 放电时溶液中的Cl-向正极移动 | |
| D. | 放电时正极周围溶液的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | Cl2+H2O═HCl+HClO | ||
| C. | Cl2+Cu$\frac{\underline{\;点燃\;}}{\;}$CuCl2 | D. | Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸锰可作为饲料添加剂用于增肥,也可用于某些化学反应的催化剂,易溶于水,不溶于乙醇.工业上常用软锰矿(主要成分为MnO2,含有MgSO4等杂质)制备硫酸锰,其简化流程如下:
硫酸锰可作为饲料添加剂用于增肥,也可用于某些化学反应的催化剂,易溶于水,不溶于乙醇.工业上常用软锰矿(主要成分为MnO2,含有MgSO4等杂质)制备硫酸锰,其简化流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液中:H+、Fe2+、Cl-、SO42- | |
| B. | 使甲基橙变红色的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1 mol•L-1的NaOH溶液中:Na+、NH4+、Cl-、HCO3- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:Ca2+、K+、ClO-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com