
| A、四种溶液的KW相同,由水电离的c(H+):①=③>②=④ |
| B、向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>① |
| C、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D、将②、③两种溶液混合后,若pH=7,消耗溶液的体积为:③>② |


科目:高中化学 来源: 题型:
| A、v(A)=0.5mol/(L?s) |
| B、v(B)=0.5mol/(L?s) |
| C、v(C)=0.8mol/(L?s) |
| D、v(D)=1mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+2a | ||
| B、+a | ||
C、+
| ||
D、+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有大量Ba2+的溶液中:Cl、K+、SO42-、CO32- |
| B、含有大量H+的溶液中:Mg2+、Na+、HCO3-、SO42- |
| C、含有大量OH-的溶液中:NH4+、NO3、SO42-、CO32- |
| D、含有大量Na+的溶液中:H+、K+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
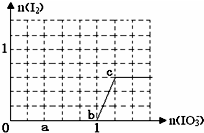 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )| A、0--b:3HSO3-+IO3-=3SO42-+I-+3H+ |
| B、a点时消耗NaHSO3的物质的量为1.2 mol |
| C、b-c间I2是既是还原产物又是氧化产物 |
| D、当溶液中I?与I2的物质的量之比为5:2时,加入的KIO3为1.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用粉末状铁代替块状铁 |
| B、用1mol?L-1HCl代替0.1mol?L-1HCl |
| C、增大压强 |
| D、改用不纯的铁代替纯铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com