
| Q1x |
| 2 |
| Q3y |
| 2 |
| Q1x |
| 2 |
| Q3x |
| 2 |
| y |
| x |
| Q1 |
| Q3 |


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
| A、在豆浆中加入盐卤做豆腐 |
| B、一束平行光线照射蛋白质溶液时,从侧面看到一条光亮的通路 |
| C、在河流的入海口易形成三角洲 |
| D、三氯化铁溶液中加入氨水出现红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、四种溶液的KW相同,由水电离的c(H+):①=③>②=④ |
| B、向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>① |
| C、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D、将②、③两种溶液混合后,若pH=7,消耗溶液的体积为:③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
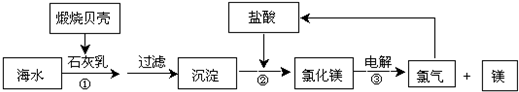
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com