
| A. | v(CO)=1.5 mol•L-1•min-1 | B. | v(NO2)=0.7 mol•L-1•min-1 | ||
| C. | v(N2)=0.4 mol•L-1•min-1 | D. | v(CO2)=1.1 mol•L-1•min-1 |
分析 把不同物质的反应速率换算成同一物质的反应速率进行比较,而同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比,据此分析解答.
解答 解:同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比,把不同物质的反应速率换算成同一物质的反应速率进行比较,数值越小的反应速率越慢,
A.v(CO)=1.5 mol•L-1•min-1;
B.v(CO)=2v(NO2)=1.4mol•L-1•min-1;
C.v(CO)=4v(N2)=1.6mol•L-1•min-1;
D.v(CO)=v(CO2)=1.1mol•L-1•min-1,
反应速率大小顺序是C>A>B>D,所以反应速率最慢的是D,故选D.
点评 本题考查化学反应速率大小比较,明确各物质反应速率与计量数的关系是解本题关键,也可以将反应速率与其计量数之比来比较反应速率大小,注意比较反应速率时单位要统一.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

| FeS04•7H2O | (NH4)2SO4 | FeSO4•(NH4)2SO4•6H2O | |
| 20℃ | 48 | 75 | 37 |
| 60℃ | 101 | 88 | 38 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解MgCl2饱和溶液,可制得金属镁 | |
| B. | 采用牺牲阳极的阴极保护法:在海轮外壳连接锌块保护外壳 | |
| C. | 金属在潮湿空气中腐蚀的实质是:M+nH2O═M(OH)n+$\frac{n}{2}$ H2↑ | |
| D. | 地下钢管与外加直流电源的正极相连以保护它不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
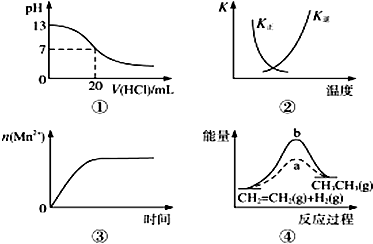
| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的p随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系可用过滤的方法进行提纯 | |
| B. | 所得的分散系中分散质为Fe2O3 | |
| C. | 当一束强光通过该分散系时会出现光亮的通路 | |
| D. | 该分散系不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| B. | H2SiO3$\stackrel{△}{→}$SiO2$\stackrel{HCl(aq)}{→}$SiCl4 | |
| C. | Al2O3 $→_{△}^{NaOH(ap)}$ NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| D. | Fe2O3$\stackrel{H_{2}SO_{4}(aq)}{→}$Fe2(SO4)3(aq)$\stackrel{△}{→}$无水Fe2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com