
【题目】实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影晌生成H2的总置,可向盐酸中加入的物质是
A.CH3COONa固体 B.NaOH溶液C.(NH4)2SO4粉末D.K2SO4固体
 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】某研究小组将纯净的SO2气体通入0.1molL﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀.为探究上述溶液中何种微粒能氧化通入的SO2 , 该小组提出了如下假设:
假设一:溶液中的NO3﹣
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25mL0.1molL﹣1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
实验2:在盛有不含O2的25mL0.1molL﹣1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
(2)为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图: 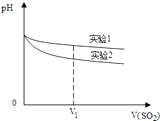
实验1中溶液pH变小的原因是;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示).
(3)该小组还设计了实验验证假设二,请在实验4横线处写出实验步骤.
实验步骤 | 实验现象 | 结论 |
实验3:在盛有不含O2的25m10.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ||
实验4: |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 同分异构体的化学性质不一定相同 B. 同素异形体的化学性质不一定相同
C. 同位素原子的化学性质不一定相同 D. 同系物的物质物理性质不一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的有( )个
①反应速率用于衡量化学反应进行的快慢
②可逆反应达到化学平衡状态时,正、逆反应速率都为0
③决定反应速率的主要因素是反应物的性质
④适当增大反应物浓度,提高反应温度都能增大反应速率
⑤不管什么反应使用催化剂,都可以加快反应速率 ,并可以使平衡移动。
⑥可逆反应A(g)![]() B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大
B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大
⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大
A.2 个 B.3 个 C.4 个 D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中的两种组成.常温下,甲是一种含氮质量分数为87.5%的液态化合物,其相对分子质量与空气中某种主要成分的相对分子质量相等;乙和丙是铜的两种常见氧化物,乙是新制氢氧化铜与乙醛反应的还原产物.试回答下列问题:
(1)甲的结构式 .
(2)甲是一种二元弱碱,则甲与过量硫酸反应的产物为(写化学式).16g甲在空气中充分燃烧,生成一种常见液态物质和氮气,放出311kJ热量,则其热化学方程式为 .
(3)甲和丙反应的产物中含有乙和一种气态单质,写出其化学方程式 .
(4)向乙的固体中加入过量硫酸酸化的硫酸铁溶液,乙固体完全溶解,得到透明溶液.
①写出其离子方程式 .
②若所得溶液中阳离子浓度均约为0.1mol/L,再向所得混合溶液中加丙,最先得到沉淀(不同浓度的阳离子开始和完全以氢氧化物沉淀的pH如图).
③向上述混合液中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶.请设计实验方案,验证有机相中含有铜元素 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在氧气中充分燃烧,生成的水蒸气和CO2的物质的量之比为1∶1,由此可得出的结论是( )
A. 该有机物分子中C、H、O原子个数比为1∶2∶3
B. 分子中碳、氢原子个数比为2∶1
C. 有机物中必定含氧
D. 无法判断有机物中是否含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中加入稀氢氧化钠溶液后,将湿润的红色石蕊试纸放在试管口 | 试纸没有变蓝色 | 溶液中不含NH4+ |
B | 溴乙烷与NaOH溶液供热后,加HNO3酸化,再加AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷发生了水解 |
C | Mg(OH)2悬浊液中加入pH=7的醋酸铵溶液 | 沉淀溶解 | 加入醋酸铵发生 NH4++OH- 使Mg(OH)2Mg2++2OH-平衡向右移动 |
D | 洁净的铁钉在浓硝酸中浸泡片刻,蒸馏水冲洗后,再加入CuSO4溶液 | 铁钉表面无红色物质生成 | 铁钉在浓硝酸中已钝化 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是( )

A. Ka(HA)=1×10-6mol/L
B. b点c (B+)=c(A-)=c(OH-)=c(H+)
C. c点时,![]() 随温度升高而减小
随温度升高而减小
D. a→c过程中水的电离程度始终增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com