
| A. | 向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 | |
| B. | 欲除去Cl2中少量的HCl气体,可将此混合气体通过盛有饱和食盐水的洗气瓶 | |
| C. | 漂白粉的有效成分是CaCl2和Ca(ClO)2 | |
| D. | 自来水可以直接养金鱼 |
分析 A.久置的氯水主要成分为HCl;
B.根据氯气难溶于饱和食盐水,HCl极易溶于水的性质分析;
C.依据漂白粉的主要成分与有效成分判断;
D.自来水中含有氯气、次氯酸能够杀死金鱼;
解答 解:A.久置的氯水主要成分为HCl,只能使紫色石蕊试液变红,故A错误;
B.氯气难溶于饱和食盐水,HCl极易溶于水,将混合气体通过盛饱和食盐水的洗气瓶,可除去HCl,故B正确;
C.漂白粉的主要成分CaCl2和Ca(ClO)2,有效成分Ca(ClO)2,故C错误;
D.自来水中含有氯气、次氯酸能够杀死金鱼,所以自来水养金鱼时,应先将水“放置”一段时间,使HClO分解,故D错误;
故选:B.
点评 本题考查氯气、氯水以及漂白粉的组成和性质,题目难度不大,本题注意把握新制氯水和久置氯水的区别.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 L浓度为0.5 mol/L 硫酸溶液中含有NA个氢离子 | |
| B. | 1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒 | |
| C. | 由14g CO中含有的原子数为NA | |
| D. | 在H2O2+Cl2═2HCl+O2反应中,每生成32 g氧气,转移电子数4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
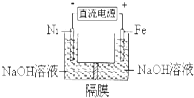
| A. | 铁是阳极,电极反应为Fe-6e-+4H2O═FeO42-+8H+ | |
| B. | 若隔膜为阴离子交换膜,则OH-自左向右移动 | |
| C. | 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 | |
| D. | 每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
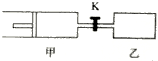 如图,甲容器有一个移动活塞,能使弃器保持恒压.起始时向甲中充入2mol SO2、1mol O2,向乙中充入4mol SO2、2mol O2.甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:2SO2(g)+O2(g)?2SO3(g).达平衡时,甲的体积为0.8L.下列说法正确的是( )
如图,甲容器有一个移动活塞,能使弃器保持恒压.起始时向甲中充入2mol SO2、1mol O2,向乙中充入4mol SO2、2mol O2.甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:2SO2(g)+O2(g)?2SO3(g).达平衡时,甲的体积为0.8L.下列说法正确的是( )| A. | 乙容器中SO2的转化率小于60% | |
| B. | 平衡时SO3的体积分数:甲>乙 | |
| C. | 打开K后一段时间.再次达到平衡.甲的体积为1.4 L | |
| D. | 平衡后向甲中再充入2mol SO2、1mol O2.和3moLSO3,平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com