解答:解:(1)①根据题意列式计算,从表中分析可知,20min时反应已达平衡,C(NH
3)=0.20mol/L
根据反应 N
2 +3H
2 2NH
3初始浓度(mol/L):0.5 1.3 0
变化浓度(mol/L):0.1 0.3 0.2
平衡浓度(mol/L):0.4 1.0 0.2
5min内,氨气生成浓度为0.08mol/L,则氮气的消耗浓度为0.04mol/L;消耗N
2的平均反应速率=
=0.008mol/L?min
K=
=
=0.1(L/mol)
2
反应达到平衡后,若往平衡体系中加入H
2、N
2和NH
3各2mol,此时氮气、氢气、氨气的浓度分别为:
0.4+1=1.4mol/L、1.0+1=2mol/L、0.2+1=1.2mol/L;计算浓度商
Q=
=
=0.13(L/mol)
2
Q>K,平衡向逆向进行,v(N
2)
正<v(N
2)
逆故答案为:0.008mol.L
-1.min
-1; 0.1;<
②A、是速率之比,反应过程中按照比例进行反应,故A不能判断该反应达到化学平衡状态;
B、按照速率之比等于系数之比,表述的是正反应速率,当某种物质的正反应速率和逆反应速率相等是表明反应达到平衡,所以当3v(N
2)
正=v(H
2)
逆 时反应达到平衡,故B不能判断该反应达到化学平衡状态;
C、反应是体积变化的反应,当容器内压强保持不变,说明反应达到平衡,故C能判断该反应达到化学平衡状态;
D、反应体系内质量守恒,体积一定,故混合气体的密度不变,所以混合气体的密度保持不变,不能说明反应达到平衡,故D不能判断该反应达到化学平衡状态;
E、此反应是反应前后气体体积改变的反应,容器内气体质量不变,气体总物质的量不变,容器内混合气体的平均分子量不变,能说明反应达到平衡,故E能判断该反应达到化学平衡状态;
故答案为:CE;
③若改变某一条件,达新平衡时n(H
2)=1.60mol,说明氢气增大,可能是改变条件平衡逆向进行,增加氢气的量;
A、平衡不一定正向进行,增大氢气的量可以符合,故A错误;
B、可能是向容器中加入了一定量的H
2气体,使氢气量增大,故B正确;
C、该反应是放热反应,降低了容器的温度,平衡向正反应方向进行,氢气的量减少,故C错误;
D、缩小容器的体积,相当于增大压强,平衡向气体体积减小的方向进行,该反应正向是气体体积减少的反应,所以缩小体积,平衡正向进行,氢气的量减少,但体积减小带来的浓度增大比平衡移动带来氢气的减少程度大,最终可以是氢气量增大,故D正确;
故答案为:CE;BD;
(2)依据平衡计算的方法列式讨论
N
2(g)+3H
2(g)?2NH
3(g)
起始量(mol/L) 0.2 0.3 0.2
变化量(mol/L)
平衡量(mol/L) a b c
反应正向进行则 0.1 0 0.4
反应逆向进行则 0.3 0.6 0
所以平衡时浓度的取值范围:0.1<a<0.3 0<b<0.6 0<c<0.4
①只有B符合;
②a的取值范围是0.1<a<0.3;
③利用极值转化进行计算
N
2(g)+3H
2(g)?2NH
3(g)
起始量(mol/L) 0.2 0.3 0.2
平衡量(mol/L) a b c
极值转化 a+0.5c b+1.5c 0
a+0.5c=0.2 b+1.5c=0.3;整理得
(Ⅰ)a与b的关系为 3a=b+0.3
(Ⅱ)a、b、c的关系 温度变化.平衡常数不变,K=0.1,根据平衡常数计算式代入得到:c
2/(a×b
3)=0.1
故答案为:①B; ②0.1<a<0.3; ③( I )3a=b+0.3;(Ⅱ)c
2/(a×b
3)=0.1;
(3)2N
2(g)+6H
2O(l)?4NH
3(g)+3O
2(g),此反应是气体体积增大的反应,所以是熵增大的反应,
故反应的△S>0;
①N
2(g)+3H
2(g)?2NH
3(g)△H=-92.4kJ/mol;氢气的燃烧热285.8kJ/mol,反应的热化学方程式为②H
2(g)+
O
2(g)=H
2O(l)△H=-285.8kJ/mol
以上两热化学方程式消去氢气合并,①×2+②×6得到热化学方程式为:2N
2(g)+6H
2O(l)?4NH
3(g)+3O
2(g)△H=+1530kJ/mol
故答案为:>;+1530 kJ/mol.



 阅读快车系列答案
阅读快车系列答案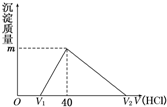 (2011?江西二模)将一定量的钠铝合金置于水中,合金全部溶解,得到20mL OH-浓度为1mol/L的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )
(2011?江西二模)将一定量的钠铝合金置于水中,合金全部溶解,得到20mL OH-浓度为1mol/L的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )