
(16分)
(I)氧化还原反应Cu+2AgNO3=Cu(NO3)2+2Ag可设计成一个原电池,
写出两个电极上的电极反应:负极:____________,正极:_____________。
(II)已知NaHCO3水溶液呈碱性:
(1)用离子方程式表示NaHCO3溶液呈碱性的原因__________________
(2) NaHCO3溶液中各离子的浓度由大到小的关系是________________
(III)某温度下,密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
|
物质 |
A |
B |
C |
|
初始浓度/mol•L—1 |
0.020 |
0.020 |
0 |
|
平衡浓度/mol•L—1 |
0.016 |
0.016 |
0.0080 |
回答下列问题:
(1)反应达到平衡时,A的转化率为_____________。
(2)该反应的化学方程式可表示为(用A、B、C表示物质的化学式)
_____________________________,其平衡常数为_______________。
(3)该温度下,若将A和B各0.10mol的气体混合物充入10L的密闭容器中发生反应,10s末达到平衡,则用A表示的化学反应速率为____________________。
(I)负极:Cu —2e—= Cu2+ 正极:2Ag++2e—=2Ag
(II)(1)HCO3—+ H2O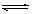 H2CO3 + OH—
H2CO3 + OH—
(2)c(Na+)>c(HCO3—)>c(OH—)>c(H+)>c(CO32—)
(III)(1) 20% (2)A(g)+B(g)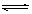 2C(g) 0.25 (3) 0.00020mol•L—1•s—1
2C(g) 0.25 (3) 0.00020mol•L—1•s—1
【解析】(1)在原电池中较活泼的金属作负极,失去电子发生氧化反应,正极得到电子,发生还原反应。根据反应可知铜失去电子,Ag+得到电子,所以正负极的电极反应式为2Ag++2e—=2Ag、Cu —2e—= Cu2+。
(2)由于碳酸氢钠在溶液中既有电离平衡,还有水解平衡。电离显酸性,水解显碱性。因为水解程度大于电离程度,所以溶液显碱性。因为在溶液中水还可以电离出氢离子,因此溶液中各离子的浓度由大到小的关系是c(Na+)>c(HCO3—)>c(OH—)>c(H+)>c(CO32—)。
(3)根据数据可知消耗A的浓度是0.020mol/L-0.016mol/L=0.004mol/L,所以A的转化率是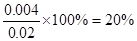 ;又因为BC的浓度变化量分别是0.004mol/L、0.008mol/L,所以ABC的浓度变化量之比是1︰1︰2,故方程式为A(g)+B(g)
;又因为BC的浓度变化量分别是0.004mol/L、0.008mol/L,所以ABC的浓度变化量之比是1︰1︰2,故方程式为A(g)+B(g)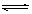 2C(g)。平衡常数是平衡时生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数为
2C(g)。平衡常数是平衡时生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数为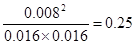 ;设A的转化量是x,则
;设A的转化量是x,则
A(g)+B(g)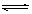 2C(g)
2C(g)
起始量(mol) 0.10 0.10 0
转化量(mol) x x 2x
平衡量(mol) 0.10-x 0.10-x 2x
根据平衡常数的表达式可知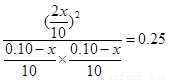
解得x=0.02。所以用A表示的化学反应速率为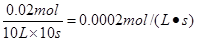 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
(16分)芳香族化合物C的分子式为C9H9OCl。C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;C与其他物质之间的转化如下图所示:
(1)C中含氧官能团的名称是 ;B→A的反应类型是 。
(2)H的结构简式是 。
(3)写出下列化学方程式:
① D与银氨溶液反应___________ ;
② E→I 。
(4)有的同学认为B中可能没有氯原子,你是__________(填“同意”或“不同意”),你的理由
_______________。
(5)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有
________种,写出其中任意一种同分异构体的结构简式___________ _。
①属于芳香族化合物 ②遇FeCl3溶液不变紫色 ③能与NaOH溶液发生反应但不属于水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分) 硫—碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2==H2SO4+2HI
II 2HI H2+I2
III 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应III易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1molO2的同时产生1 molH2
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)= 。该温度下,H2(g)+I2(g)2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
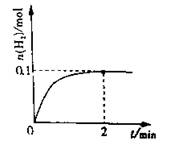
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知 2H2(g)+O2(g)====2H2O(l) △H=-572kJ·mol-1
某氢氧燃料电池释放22.8kJ电能时,生成1mol液态水,该电池的能量转化率为 。
查看答案和解析>>
科目:高中化学 来源:2013届广东省四会市四会中学第一次考试理科综合化学试卷(带解析) 题型:填空题
(16分)化合物IV为一种重要化工中间体,其合成方法如下: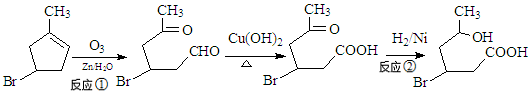
(1)化合物II的化学式为
(2)反应②的反应类型为 ,1mol化合物III与足量NaOH反应消耗NaOH的物质的量为 。
(3)化合物I在NaOH的醇溶液中反应得到化合物X,写出化合物X可能的结构简式
(4)化合物IV在浓硫酸条件下反应生成的六元环化合物V,写出该反应的化学方程式
(5) 异黄樟油素( )发生类似反应①的反应,得到乙醛和化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为______________________。
)发生类似反应①的反应,得到乙醛和化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省台州市高一上学期期末考试化学试卷 题型:实验题
(16分)我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图: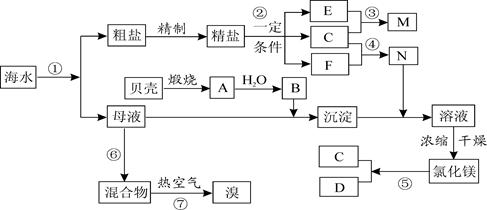
请根据以上信息回答下列问题:
I.(1)写出N的化学式和B的名称:N 、B 。
(2)写出反应②的化学方程式,并标出其电子转移的方向和数目:
(3)写出反应③的离子方程式: ,
Ⅱ.粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:①盐酸 ②氯化钡溶液
③氢氧化钠溶液 ④碳酸钠溶液,以上试剂添加的顺序可以为 。
A. ②③④① B. ③④②① C. ④③②① D. ③②④①
Ⅲ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2。
(1)若用来提取Mg,根据上述提取Mg的流程,没有涉及到的反应类型是 。
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)若用来提取Br2,反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是 。
A.从外地购买 B.在当地新建生产厂
C.从本厂生产烧碱处循环 D.从本厂生产镁 单质处循环
单质处循环
流程⑦将溴单质从混合物中分离出来是基于溴单质具有 性。
(3)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2
乙:母液先提取Br2,后提取Mg
请你判断哪个更合适? (填“甲”或“乙”),理由是 。
(填“甲”或“乙”),理由是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省洪湖市四校高二下学期期中联合考试化学试卷(带解析) 题型:实验题
(16分)
(I)氧化还原反应Cu+2AgNO3=Cu(NO3)2+2Ag可设计成一个原电池,
写出两个电极上的电极反应:负极:____________,正极:_____________。
(II)已知NaHCO3水溶液呈碱性:
(1)用离子方程式表示NaHCO3溶液呈碱性的原因__________________
(2) NaHCO3溶液中各离子的浓度由大到小的关系是________________
(III)某温度下,密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
| 物质 | A | B | C |
| 初始浓度/mol?L—1 | 0.020 | 0.020 | 0 |
| 平衡浓度/mol?L—1 | 0.016 | 0.016 | 0.0080 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com