
【题目】(1)V L Fe2(SO4)3溶液中含有Fe3+ m g,则![]() 的物质的量浓度为____________。
的物质的量浓度为____________。
(2)3.01×1023个分子CO2在标准状况下体积是_______L,它与________g CO含有相同的氧原子数。
(3)将4 mL 37%的盐酸(密度为1.19 g·cm3)加水稀释到200 mL,稀释后盐酸的物质的量浓度是
_____________。
(4)在标准状况下22.4 L由氮气和氧气组成的混合气体,其质量为30 g,则其中氧气的质量为
____________g。
(5)同温同压下,同体积的H2和A气体的质量分别为1.0 g和16.0 g,则A的相对分子质量为
____________g。
【答案】(1)![]() mol/L(2分)
mol/L(2分)
(2)11.2(1分) 28(1分)
(3)0.24 mol/L(2分)
(4)16(2分)
(5)32(2分)
【解析】(1)V L Fe2(SO4)3溶液中含有Fe3+ m g,物质的量为![]() ,根据硫酸铁的化学式可知
,根据硫酸铁的化学式可知![]() 的物质的量是
的物质的量是![]() ,则
,则![]() 的物质的量浓度为
的物质的量浓度为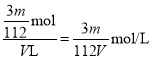 。
。
(2)3.01×1023个CO2分子在标准状况下体积是![]() 。其中含有1 mol氧原子,则它与28 g CO含有相同的氧原子数。
。其中含有1 mol氧原子,则它与28 g CO含有相同的氧原子数。
(3)37%的盐酸(密度为1.19 g·cm3)的浓度为![]() =12 mol/L。将4 mL此浓盐酸加水稀释到200 mL,即稀释了50倍,因此稀释后盐酸的物质的量浓度是12 mol/L÷50=0.24 mol/L。
=12 mol/L。将4 mL此浓盐酸加水稀释到200 mL,即稀释了50倍,因此稀释后盐酸的物质的量浓度是12 mol/L÷50=0.24 mol/L。
(4)在标准状况下22.4 L由氮气和氧气组成的混合气体的物质的量是1 mol,其质量为30 g,因此混合气体的平均相对分子质量是30,可求得氮气和氧气的物质的量之比是1∶1,说明氧气是0.5 mol,则其中氧气的质量为16 g。
(5)同温同压下,同体积的H2和A气体的质量分别为1.0 g和16.0 g,二者的物质的量相等,A的物质的量是1 g÷2 g/mol=0.5 mol,则A的相对分子质量为16÷0.5=32。


科目:高中化学 来源: 题型:
【题目】海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等。某化学兴趣小组为了从海水中分离出氯化钠,设计了如下实验方案:
海水 滤液
滤液 滤液
滤液 NaCl溶液
NaCl溶液![]() NaCl
NaCl
(1)步骤Ⅰ中试剂A为________,加入过量A的目的是________。
(2)步骤Ⅱ中试剂B为________,加入过量B的目的是________。
(3)步骤Ⅲ中试剂C为_____,加入过量C至______,其目的是________。
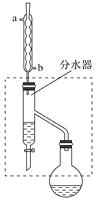
(4)步骤Ⅳ的实验操作为________,试根据图示回答:

①按顺序写出图中编号仪器的名称:_________________________;
②仪器a的作用是________,其目的是_________________________。
③当仪器b中出现________时即可停止加热。
(5)该化学兴趣小组用分离得到的氯化钠配制100 mL 1 mol/L的NaCl溶液,配制过程中需用托盘天平称取精盐的质量为______g,用于定容的玻璃仪器的规格和名称是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法不正确的是
A.用铜丝燃烧法法可定性确定有机物中是否存在卤素
B.做过碘升华实验的试管可先用酒精清洗,再用水清洗
C.可用去锈细铁丝或铂丝进行焰色反应实验
D.红外光谱仪可用来确定物质中含有哪些金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
物质 | 乙酸 | 正丁醇 | 乙酸丁酯 |
熔点/ ℃ | 16.6 | -89.5 | -73.5 |
沸点/ ℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从________(填“a”或“b”)管口通入;通过分水器下端旋塞分出的生成物是________,其目的是_____________________________。
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。
①正确的操作步骤是________(填标号)。
A.①②③④ B.③①④②
C.①④①③② D.④①③②③
②分液漏斗有两种,如下图。分液时应选择下图中________形分液漏斗,其原因是_____________________________________________。

③蒸馏操作时,需收集________ ℃的馏分,沸点大于140 ℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A.含金属元素的离子,不一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法中,不正确的是( )
A. SO2可用于漂白纸浆 B. SiO2是良好的半导体材料
C. 硅单质可用来制造太阳能电池 D. Cl2可用于消毒和制造漂白粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产和生活息息相关。下列说法错误的是( )
A. 以Na2O2作供氧剂时,发生了氧化还原反应
B. 人工合成食品级酯可以用作糖果的香料
C. 在食品袋中放人CaCl26H2O,可防止食物受潮
D. 用NH4Cl浓溶液除铁锈,因为NH4Cl水解显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白[第(1)~(4)小题用元素符号填写]。
(1)第三周期原子半径最小的元素________。
(2)第一电离能最大的元素________。
(3)电负性最大的元素________。
(4)第四周期中第一电离能最小的元素________。
(5)含有8个质子,10个中子的原子的化学符号________。
(6)最外层电子排布为4s24p1的原子的核电荷数为________。
(7)周期表中最活泼的非金属元素原子的轨道表示式为___________________。
(8)某元素核外有三个电子层,最外层电子数是核外电子总数的![]() ,写出该元素原子的电子排布式是__________________。
,写出该元素原子的电子排布式是__________________。
(9)写出铜元素在周期表中的位置________________,它位于________区。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com