已知X、Y、Z、W四种元素分布在元素周期表中的三个不同短周期元素里,且原子序数依次增大,X、W同主族,Y、Z为同周期的相邻元素,W原子的质子数等于Y、Z原子最外层电子数之和,Z原子最外层电子数是次外层电子数的3倍.试推断:
(1)写出X、Y的元素符号:X______、Y______.
(2)W+和Z2-的核外电子排布相同,两种微粒半径大小关系为______.
(3)由X、Y、Z所形成的离子化合物的化学式是______,它与W的最高价氧化物的水化物的溶液反应时的离子方程式是______.
(4)已知拆开1mol X-X键、1mol Y≡Y、1mol Y-X键分别需要吸收的能量为436kJ、946kJ、391kJ.则由X2和Y2反应生成1mol YX3,需要______(填“放出”或“吸收”)的热量是______kJ.
【答案】分析:X、Y、Z、W四种元素分布在元素周期表中的三个不同短周期元素里,且原子序数依次增大.Z原子最外层电子数是次外层电子数的3倍,Z有2个电子层,最外层有6个电子,则Z为O元素;Y、Z为同周期的相邻元素,Y的原子序数较小,故Y为N元素;W原子的质子数等于Y、Z原子最外层电子数之和,则W的质子数为5+6=11,则W为Na元素;X、W同主族,所以X为H元素,根据原子核外电子排布特点判断元素在周期表中的位置,结合元素对应的单质、化合物的性质作进一步解答.
解答:解:X、Y、Z、W四种元素分布在元素周期表中的三个不同短周期元素里,且原子序数依次增大.Z原子最外层电子数是次外层电子数的3倍,Z有2个电子层,最外层有6个电子,则Z为O元素;Y、Z为同周期的相邻元素,Y的原子序数较小,故Y为N元素;W原子的质子数等于Y、Z原子最外层电子数之和,则W的质子数为5+6=11,则W为Na元素;X、W同主族,所以X为H元素,
(1)由上述分析可知,X为H元素,Y为N元素,故答案为:H;N;
(2)Na+和O2-的核外电子排布相同,核电荷数越大离子半径越小,故离子半径O2->Na+,故答案为:O2->Na+;
(3)由X、Y、Z所形成的离子化合物为NH4NO3,与NaOH溶液反应生成NH3?H2O,反应的离子方程式为NH4++OH-=NH3?H2O,
故答案为:NH4NO3;NH4++OH-=NH3?H2O;
(4)由H2和N2反应生成1molNH3,△H=436kJ/mol+946kJ/mol-3×391kJ/mol=-46kJ/mol,故放出46kJ热量,
故答案为:放出;46.
点评:本题考查结构性质位置关系、离子半径比较、元素化合物知识、反应热有关计算等,难度不大,注意基础知识的掌握.



 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案















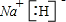
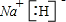
 已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)
已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)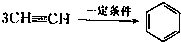 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式: