
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:


(1)常温下含碳量最高的气态烃是________(填字母)。
(2) E的一氯取代物同分异构有_______种。
(3)一卤代物种类最多的是________(填写字母)。
(4) 能够发生加成反应的烃有________(填写字母)。
(5)写出C的加聚反应的化学方程式:______________________。
【答案】 D 2 4 G 略
【解析】根据结构模型可知A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷,F为苯,G为甲苯。
(1)常温下,分子中含有碳原子个数不大于4的烃为气态烃,根据其球棍模型判断,分子中含有碳氢原子个数比最大即为含碳量最高的,所以含碳量最大的是乙炔,故答案为:D;
(2) 丙烷分子中含有2种化学环境的氢原子,一氯取代物有2种,故答案为:2;
(3)甲烷、乙烷、乙烯、乙炔、苯的一卤代物都只有1种,丙烷的一卤代物有2种,甲苯的有一卤代物有4种,故答案为:G;
(4)含有碳碳双键或三键或苯环的烃能发生加成反应,所以乙烯、乙炔、苯和甲苯都能发生加成反应, 故答案为:CDFG;
(5)乙烯分子间发生加成聚合反应生成高分子化合物聚乙烯;反应的化学方程式为:![]() ;故答案为:
;故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】烟气中SO2和NOx(NO及NO2)的脱除对于环境保护意义重大。
(1)湿式氨法烟气脱硫脱氮是通过氨水吸收烟气,得到含NH4+、SO32-、SO42-、HSO3-、和NO2-的吸收液。
① 用离子方程式解释吸收液中含有SO32-的原因:_______________。
② 吸收液中的SO32-、HSO3-均对NO2具有吸收作用,但HSO3-对NO2的吸收能力比SO32-弱。
a. SO32-与NO2反应生成NO2-的离子方程式是_______________________。
b. 经测定,在烟气的吸收过程中,吸收液对NO2的吸收率随烟气通入量变化的曲线如下图所示。

结合化学用语解释产生上述结果的原因:_____________。
(2)二氧化氯(ClO2)具有很强的氧化性,可用于烟气中SO2和NO的脱除。
① 酸性条件下,电解NaClO3溶液,生成ClO2的电极反应式是__________。
② 研究表明:ClO2氧化SO2和NO的反应历程与下列反应有关。
i.NO + ClO2 === NO2+ ClO
ii.NO + ClO === NO2 + Cl
iii.SO2 + ClO2 === SO3+ ClO
iv.SO2 + ClO === SO3 + Cl
实验测得:ClO2分别氧化纯SO2和纯NO的氧化率以及ClO2氧化SO2和NO混合气中的SO2氧化率随时间的变化情况如下图所示。

a. 结合上述信息,下列推论合理的是________(填字母序号)。
A. NO的存在会影响ClO2氧化SO2的反应速率
B. ClO2氧化SO2的反应速率慢于ClO2氧化NO的反应速率
C. 反应i中生成的NO2可以加快ClO2氧化SO2的反应速率
b. 结合反应历程,分析混合气中SO2氧化速率较纯SO2氧化速率快的可能原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某矿石(仅含两种元素)的组成和性质,设计并完成如下实验:
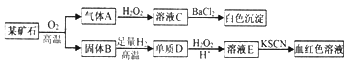
请回答:(1)某矿石的组成元素为__________(用元素符号表示)。
(2)气体A与H2O2溶液反应的化学方程式是________________。
(3)写出D→E的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti原子电子占据的最高能层符号________,基态Ti2+的价电子的电子排布式_____________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2![]() 2NH3实现储氢和输氢。下列说法正确的是______(填字母)。
2NH3实现储氢和输氢。下列说法正确的是______(填字母)。
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH4+与ClO4-、PH4+、CH4、BH4-互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.电负性C<N<O , 第一电离能C<O<N
(3)Se与O同族,则 SeO2分子的空间构型为_______________。
(4)富勒烯(C60)的结构如图甲,分子中碳原子轨道的杂化类型为__________;1 mol C60分子中σ键的数目为________个。
(5)图乙为一个金属铜的晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g·cm-3,则阿伏加德罗常数可表示为__________ mol-1(用含a、ρ的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中锗(Ge与碳同主族)元素处于最高价态,铋元素(Bi与氮同主族)的价态与它跟氯形成某种共价氯化物所呈的价态相同,且此氯化物中铋具有8电子稳定结构。BGO的化学式是( )
A. Bi3Ge3O15 B. Bi4Ge3O12 C. Bi4Ge3O16 D. Bi3Ge3O12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,粒子的物质的量浓度关系正确的是( )
A. 向醋酸钠溶液中加入适量醋酸得到酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B. 0.1 mol·L-1NH4Cl溶液:c(NH![]() )=c(Cl-)
)=c(Cl-)
C. 0.1 mol·L-1Na2CO3溶液:c(OH-)=c(H+)+c(HCO![]() )+2c(H2CO3)
)+2c(H2CO3)
D. 向硝酸钠溶液中滴加稀盐酸得到pH=5的溶液:c(Na+)=c(NO![]() )+c(Cl-)
)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知;还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图。下列说法正确的是()

A.反应过程中的氧化产物均为Na2SO4
B.a 点时消耗NaHSO3的物质的量为1.0mol
C.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
D.当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com