
【题目】氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti原子电子占据的最高能层符号________,基态Ti2+的价电子的电子排布式_____________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2![]() 2NH3实现储氢和输氢。下列说法正确的是______(填字母)。
2NH3实现储氢和输氢。下列说法正确的是______(填字母)。
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH4+与ClO4-、PH4+、CH4、BH4-互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.电负性C<N<O , 第一电离能C<O<N
(3)Se与O同族,则 SeO2分子的空间构型为_______________。
(4)富勒烯(C60)的结构如图甲,分子中碳原子轨道的杂化类型为__________;1 mol C60分子中σ键的数目为________个。
(5)图乙为一个金属铜的晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g·cm-3,则阿伏加德罗常数可表示为__________ mol-1(用含a、ρ的代数式表示)。

【答案】 N 3d2 cd V形或角形 sp2 90NA ![]()
【解析】(1)Ti的原子序数为22,其电子排布式为1s22s22p63s3p63d24s2,所以Ti最高能层为N层,基态Ti2+价电子排布式为3d2。
(2)a项,NH3分子中N原子含有3个共用电子对和一个孤电子对,其价层电子对是4,采用sp3杂化,a错误;b项,等电子体为原子数相等和价电子数相等的原子团,NH![]() 与PH
与PH![]() 、CH4、BH
、CH4、BH![]() 均含有5个原子团,且价电子均为8,为等电子体,而ClO
均含有5个原子团,且价电子均为8,为等电子体,而ClO![]() 价电子数为32,不属于等电子体,b错误;c项,分子间存在氢键的熔沸点高,相同压强时,氨气中含有氢键,PH3中不含氢键,所以NH3沸点比PH3高,c正确;d项,电负性C<N<O,第一电离能C<O<N,d正确。
价电子数为32,不属于等电子体,b错误;c项,分子间存在氢键的熔沸点高,相同压强时,氨气中含有氢键,PH3中不含氢键,所以NH3沸点比PH3高,c正确;d项,电负性C<N<O,第一电离能C<O<N,d正确。
(3)二氧化硒分子中价层电子对=2+![]() ×(6-2×2)=3,且含有一个孤电子对,所以属于V形。
×(6-2×2)=3,且含有一个孤电子对,所以属于V形。
(4)每个碳原子含有的σ键个数为3且不含孤电子对,所以采用sp2 杂化,每个碳原子含有的σ键个数为3/2,所以1 mol C60分子中σ键的数目=![]() ×60NA=90NA。
×60NA=90NA。
(5)晶胞中含有铜原子数目=8×![]() +6×
+6×![]() =4,则晶胞质量为4×64÷NA g,该晶胞体积为(a×10-10 cm)3,则4×64÷NA g=(a×10-10 cm)3×ρ g·cm-3,故NA=
=4,则晶胞质量为4×64÷NA g,该晶胞体积为(a×10-10 cm)3,则4×64÷NA g=(a×10-10 cm)3×ρ g·cm-3,故NA=![]() 。
。


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验:
甲同学向1 mol·L1氯化铁溶液中加入少量的NaOH溶液;
乙同学直接加热饱和FeCl3溶液;
丙同学向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中能得到Fe(OH)3胶体的同学是 。
(2)证明有Fe(OH)3胶体生成的实验操作是 。
(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带 电荷(填“正”或“负”)。
②向其中加入饱和Na2SO4溶液,产生的现象是 。
(4)Fe(OH)3胶体能稳定存在的主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示。下列说法正确的是
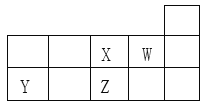
A. Y、Z、X三种元素的原子半径依次增大
B. X、Z都是第2周期VIA族元素,单质的氧化性X>Z
C. Y的气态氢化物的热稳定性比Z的高
D. R元素与W同族且相邻周期,则R元素最高价氧化物的水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的甲烷和氯气混合后,在漫射光的照射下充分反应,生成物中物质的量最大的是
A、CH3Cl B、CH2Cl2 C、HCl D、CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:


(1)常温下含碳量最高的气态烃是________(填字母)。
(2) E的一氯取代物同分异构有_______种。
(3)一卤代物种类最多的是________(填写字母)。
(4) 能够发生加成反应的烃有________(填写字母)。
(5)写出C的加聚反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,用煮沸过的蒸馏水溶解14gKOH配成250mL溶液,取出50mL溶液与CO2恰好完全反应(溶液体积变化忽略不计)。
(1)取出的50mLKOH溶液的pH=___________。
(2)若反应后溶液中c(CO32-)=c(HCO3-),则溶液中c(HCO3-)=_______mol·L-1(H2CO3忽略不计,计算结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力与加水量的关系。回答下列问题:

(1)0”点导电能力为0的理由__________________________________;
(2)a、b、c三点溶液中氢离子浓度由小到大的顺序为________________________;
(3)a、b、c三点中,醋酸的电离程度最大的一点是_____________;
(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择__________;
A.加热 B.加水 C.加CH3COONa固体 D.加很稀的NaOH溶液
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是____________。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.c(H+)/c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.3 g纯净的金属钠在干燥的空气中,被氧化后得到3.5 g固体,由此可判断出产物是
A. 氧化钠 B. 过氧化钠
C. 氧化钠和过氧化钠的混合物 D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com