
确认能发生化学平衡移动的是( )
A.化学反应速率发生了改变
B.有气态物质参加的可逆反应达到平衡后,改变压强
C.由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变
D.可逆反应达到平衡后,使用催化剂
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列判断正确的是
A.22.4L氢气中含有的氢分子数目是NA B.36gH2O含有的氧原子数目是2NA
C. 1 mol/LBaCl2溶液中含有Cl-数目是2 NA D.1mol H2在Cl2中完全燃烧转移的电子数是NA
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具,下列化学用语中,正确的是( )
A、电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
B、氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- = 4OH-
C、镀件上电镀铜时,纯铜做阴极,电极反应式为:Cu -2e- = Cu2+
D、钢铁发生电化学腐蚀的正极反应式:Fe-2e- = Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
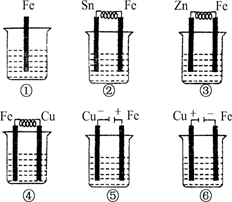
如下图所示,各烧杯中盛有海水,铁(含杂质C)在其中被腐蚀由快到慢的顺序为( )
A.②①③④⑤⑥ B.⑤④③①②⑥
C.⑤④②①③⑥ D.⑤③②④①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
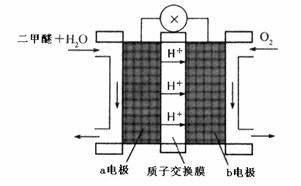
二甲醚(CH3OCH3)被称为21世纪界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)若要增大反应①中H2的转化率,在其它条件不变的情况下可以采取的措施为 。
A.加入某物质作催化剂 B.加入一定量CO C.反应温度降低 D.增大容器体积
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率
为 ;
若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H= 。
CH3OCH3(g)+CO2(g)的△H= 。
(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如上图所示。b电极是 极,写出b电极上发生的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2O (g) == H2O (l) ΔH1=-Q1 kJ·mol-1 ;CH3OH(g) == CH3OH(l) △H2=-Q2 kJ·mol-1
2CH3OH(g) +3O2(g) == 2CO2(g)+4H2O(g) △H3=-Q3 kJ·mol-1 (Q1、Q2、Q3均大于0)若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为( )
A. Q1+Q2+Q3 B. 0.5Q3-Q2+2Q1
C. 0.5Q3+Q2-2Q1 D. 0.5(Q1+Q2+Q3)
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论正确的是( )。
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,因为反应条件的改变,反应产物可以不同的是( )
A.钠与氧气的反应 B.稀盐酸和硝酸银溶液
C.铁在氯气中燃烧 D.一氧化碳在氧气中燃烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com