
可以证明可逆反应N2 + 3H2 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N断裂的同时,有3个H-H键断裂;
②一个N≡N键断裂的同时,有6个N-H键断裂;
③其它条件不变时,混合气体平均相对分子质量不再改变;
④保持其它条件不变时,体系压强不再改变;
⑤NH3、N2、H2的体积分数都不再改变;
⑥恒温恒容时,混合气体的密度保持不变;
⑦正反应速率v(H2) = 0.6 mol/(L·min),逆反应速率v(NH3) = 0.4 mol/(L·min)
A.全部 B.①③④⑤ C.②③④⑤⑦ D.③⑤⑥⑦
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
有下列几组物质(将正确答案字母填入空中)
A.金刚石和石墨 B.C2H6和C5H12 C.C2H4和C2H6
D.CH3CH2CH2CH3和CH3CH(CH3)2 E.35Cl和37Cl
属于同分异构体的是________;属于同素异形体的是_______;属于同系物的是________;属于同位素的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.加入合金的质量可能为9.6g
B.沉淀完全时消耗NaOH溶液体积为150mL
C.参加反应的硝酸的物质的量为0.4mol
D.溶解合金时产生NO气体体积0.224L(以标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
I. 将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2,制得混有SiCl4杂质的TiCl4。
II. 将混有SiCl4杂质的TiCl4分离,得到纯净的TiCl4。
III. 在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O。
IV. TiO2·xH2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是_______。II中所采取的操作名称_______。
|

②如实验IV中,应将TiO2.xH2O放在_______ (填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2→2O b. O+H2O→2OH(羟基) c. OH+OH→H2O2
①b中破坏的是 (填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的 等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
(3)过氧化氢是重要的化学试剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。
请填写下列空白:
①取10.00 mL密度为P g/mL的过氧化氢溶液稀释至250 mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数配平及化学式填写在方框里。
 MnO+ H2O2+ H+= Mn2++ H2O+
MnO+ H2O2+ H+= Mn2++ H2O+
②滴定时,将高锰酸钾标准溶液注入______________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是____________________________。
③重复滴定三次,平均耗用C mol/L KMnO4标准溶液 V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________ (填“偏高”或“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280 kJ,断裂1molF-F 、S-F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
A.-1780kJ/mol B.-1220 kJ/mol C.-450 kJ/mol D.+430 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是( )
A.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
B.等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),放出的能量相同
C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D.氢气的燃烧热为285.8 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)=2H2(g) + O2(g) ΔH=+ 571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下在容积不变的密闭容器中发生如下反应:2SO2+O2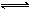 2SO3(g),若开始时只充入2 molSO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为
2SO3(g),若开始时只充入2 molSO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为
A.20% B.40% C.50% D.60%
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,浓度都为1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,4 s后X2、Y2、Z的浓度分别是0. 4 mol·L-1,0.8 mol·L-1,0.4 mol·L-1,如Z用X、Y表示,则该反应式是( )
A.X2+2Y2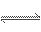 2XY2 B.2X2+Y2
2XY2 B.2X2+Y2 2X2Y
2X2Y
C.3X2+Y2 2X3Y D.X2+3Y2
2X3Y D.X2+3Y2 2XY3
2XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
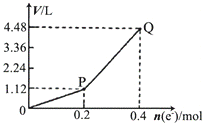
用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如右图所示。横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。下列判断正确的是 ( )
A.电解过程中,溶液的pH不断增大
B.当转移0.4mol e-时,电解生成的铜为6.4g。
C.阳极电极反应式为2H2O + 4e-=4H++O2↑
D.Q点对应的气体中,H2与O2的体积比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com