
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
I. 将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2,制得混有SiCl4杂质的TiCl4。
II. 将混有SiCl4杂质的TiCl4分离,得到纯净的TiCl4。
III. 在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O。
IV. TiO2·xH2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是_______。II中所采取的操作名称_______。
|

②如实验IV中,应将TiO2.xH2O放在_______ (填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2→2O b. O+H2O→2OH(羟基) c. OH+OH→H2O2
①b中破坏的是 (填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的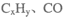 等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
(3)过氧化氢是重要的化学试剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。
请填写下列空白:
①取10.00 mL密度为P g/mL的过氧化氢溶液稀释至250 mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数配平及化学式填写在方框里。
 MnO+ H2O2+ H+= Mn2++ H2O+
MnO+ H2O2+ H+= Mn2++ H2O+
②滴定时,将高锰酸钾标准溶液注入______________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是____________________________。
③重复滴定三次,平均耗用C mol/L KMnO4标准溶液 V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________ (填“偏高”或“偏低”或“不变”)。
【知识点】制备实验方案的设计;化学方程式的有关计算;极性键和非极性键;氧化还原反应;直接加热的仪器及使用方法;物质分离和提纯的方法和基本操作综合应用
【答案解析】(1)①液态(1分) 蒸馏(1分) ② b (1分)
(2)①极性共价键 (1分) ②氧化性(1分)
(3)①2 5 6 2 8 5O2 ↑ (2分)
②酸式(1分)滴入最后一滴高锰酸钾溶液时,溶液呈浅红色,且半分钟内不褪色
(2分)
③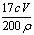 (3分) ④偏高 (2分)
(3分) ④偏高 (2分)
解析:(1)①根据资料卡片中的TiCl4与SiCl4熔点、沸点可知,TiCl4与SiCl4在常温下的状态是液态;分离沸点相差较大的互溶液体常采取蒸馏方法;
②Ⅳ为烧杯与蒸发皿通常进行液态加热,高温分解固体物质常在坩埚中进行;
①由2O+H2O→2OH,可知水中O-H键断裂,O-H键属于极性共价键;
②CxHy、CO等具有还原性,H2O2具有强氧化性,H2O2能氧化CxHy、CO等,清除路面空气中的CxHy、CO等,故答案为:氧化性;
①方程式中,高锰酸钾有强氧化性,能将双氧水氧化为氧气,先确定缺的是O2,锰元素化合价降低了5价,生成1mol氧气时,氧元素化合价升高2价,根据电子转移守恒,配平化学方程式高锰酸根前面的系数为2,双氧水前面的系数为5,根据原子守恒来配平其他物质前面的系数,答案为:2、5、6、2、8、502;
②由于高锰酸钾标准溶液具有强氧化性,所以只能使用酸式滴定管,滴定到达终点的现象是:滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色,故答案为:酸式;滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色;
③根据化学方程式可以得到关系式:2MnO4-~5H2O2,耗用c mol/L KMnO4标准溶液V mL,即cV×10-3mol的高锰酸钾时,所用双氧水的物质的量:2.5cV×10-3mol,则原过氧化氢的质量为:0.025cVmol×34g/mol=0.85cV,过氧化氢溶液中过氧化氢的质量分数为: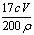 ;
;
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,有一部分溶液占据了气泡的体积,并没有滴入锥形瓶,则测定结果偏高。
【思路点拨】本题考查学生阅读题目获取信息能力、物质分离提纯等基本操作、对实验原理装置的理解等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
将甲烷与氯气混合,在光照下充分反应,所得产物有:①CH3Cl,②CH2Cl2,③CHCl3,④CCl4,⑤HCl。其中正确的是 ( )
A.①⑤ B.②⑤ C.①②③的混合物 D.①②③④⑤的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
易燃易爆有毒的化学物质在其包装上应贴上危险警告标签。下列物质贴错了标签的是
| A | B | C |
| |
| 物质的化学式 | 浓H2SO4 | CCl4 | P4 | NH4NO3 |
| 危险警告标签 | 腐蚀品 | 易燃品 | 剧毒品 | 爆炸品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A含硫(每个分子只含一个硫原子)、氧以及一种或几种卤素;少量A与水反应可完全水解而不被氧化或还原,所有反应产物均可溶于水;将A配成水溶液稀释后 分成几份,分别加入一系列的试剂,现象如下:
分成几份,分别加入一系列的试剂,现象如下:
①加入硝酸和硝酸银,产生白色沉淀;
②加入氯化钡溶液,无沉淀生成;
③溶液经酸化后加入高锰酸钾溶液,紫色褪去,再加入硝酸钡溶液,产生白色沉淀;
(1)由此判断组成该化合物的元素中,可能存在的卤素有____________,A与水反应后生成的溶液中含有的离子可能有_________________________。
(2)要确定该化合物的分子式,称取11.90g A溶于水稀释至250.0mL,取25.00mL溶液加入足量的高锰酸钾溶液和硝酸钡溶液,使沉淀完全,沉淀经洗涤、干燥后称重,为2.33g,试确定A的化学式,写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应 经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A、反应在前5 s的平均速率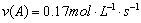
B、保持其他条件不变,升高温度,平衡时 ,则反应的
,则反应的
C、相同温度下,起始时向容器中充入2.0 mol C达到平衡时,C的转化率大于80%
D、相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.放热反应在任何条件都能自发进行
B.应用盖斯定律,可计算某些难以直接测量的反应焓变
C.任何能使熵值增大的过程都能自发进行
D.△H>0,△S<0的化学反应一定能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
可以证明可逆反应N2 + 3H2 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N断裂的同时,有3个H-H键断裂;
②一个N≡N键断裂的同时,有6个N-H键断裂;
③其它条件不变时,混合气体平均相对分子质量不再改变;
④保持其它条件不变时,体系压强不再改变;
⑤NH3、N2、H2的体积分数都不再改变;
⑥恒温恒容时,混合气体的密度保持不变;
⑦正反应速率v(H2) = 0.6 mol/(L·min),逆反应速率v(NH3) = 0.4 mol/(L·min)
A.全部 B.①③④⑤ C.②③④⑤⑦ D.③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1) m+n_________p(填“>”“=”“<”)。
(2)若加压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
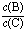 (3)若加入A(体积不变),则B的转化率_________。
(3)若加入A(体积不变),则B的转化率_________。
(4)若降低温度,则平衡时B、C的浓度之比 将______ ___。
(5)若加入催化剂,平衡时气体混合物的总物质的量____ _____。
(6)若B是有色物质,A、C均无色,维持容器内压强不变,充入氖气时,混合物颜色____ (填“变深”“变浅”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.需要加热才能发生的反应一定是吸热反应。
B.任何放热反应在常温条件下一定能够发生。
C.反应物和生成物所具有的总能量的差决定了化学反应是放热还是吸热。
D.构成物质微粒间的化学键键能越小,该物质的能量就越低,物质越稳定。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com