
下列有关化学电源电极的叙述不正确的是( )。
A.锌锰碱性电池的负极材料为锌 B.铅蓄电池的负极材料为铅
C.镍镉电池的负极材料为镍 D.锂电池的负极材料为锂
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是
( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,根据表中10种元素,用元素符号或化学式填空。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑨ | ⑧ | ⑩ |
(1)①~⑩元素中,金属性最强的是 ;化学性质最不活泼的是 。
(2)①~⑩元素中,最高价氧化物水化物呈两性的是 ,该化合物与NaOH溶液反应的离子方程式为 ;
(3)①~⑩元素中,最高价氧化物水化物酸性最强的是 ,碱性最强的是 ;
(4)⑤、⑥、⑧、⑨所形成的离子,其半径由小到大的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )。
A、84gNaHCO3晶体中含有NA个CO32-
B、9.2gNO2和N2O4的混合气体中含有的氮原子数为0.2NA
C、标准状况下,11.2L臭氧中含NA个氧原子
D.标准状况下,由Na2O2制得11.2 L O2,反应转移的电子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)—空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%—30%的KOH溶液。电池总反应为:N2H4+O2=N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是( )。
A.电池工作时,溶液中负极附近溶液的碱性增强,而电解质溶液pH减小
B.正极的电极反应式是:O2+4H++4e-=2H2O
C.负极的电极反应式是:N2H4+4OH――4e-=4H2O+N2↑ D.溶液中阴离子向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
利用化合价和物质类别推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①将 通入酸性
通入酸性 溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________.
溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________.
A.  B.
B.  C.
C.  D.
D. 
②亚硫酸钠中的硫呈+4价,它既有氧化性又有还原性,现在有试剂:溴水、H2S、稀硫酸。请选取合适的试剂证明Na2SO3具有还原性,并写出该反应的离子方程式为:_____________________________.
(2)从物质分类的角度可以推测物质的性质。
①已知蛇纹石由 、
、 、
、 、
、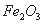 组成。其中属于碱性氧化物的是______________________________。
组成。其中属于碱性氧化物的是______________________________。
②现取一份蛇纹石试样进行实验:
I. 先将其溶于过量的盐酸中、过滤,滤渣的主要成分是______________。
II. 再向滤液中加入 溶液至过量、过滤,滤渣中的主要成分是__________________。
溶液至过量、过滤,滤渣中的主要成分是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙三种醇与足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为6:2:3,则甲乙丙三种醇分子里的羟基数之比为
A.1:3:3 B.2:1:3 C.6:3:2 D.1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知金属活动相差越大,形成原电池时越容易放电。请根据如图装置,回答下列问题:

(1)各装置名称是:A池________,B池______,C池________。
(2)写出电极上发生的反应:①_____________,③___________,⑤_____________。
(3)当电路上有2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com