
| A. | 标准状况下,0.5NA个Br2分子所占的体积为11.2 L | |
| B. | 在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后得到的NH3分子数小于NA | |
| C. | 标准状况下,6.72 L Cl2与足量的NaOH溶液反应,转移的电子数为0.3NA | |
| D. | 在0.1 mol•L-1NH4Cl溶液中阳离子的数目可能为NA |
分析 A.标准状况下Br2为液态;
B.合成氨气为可逆反应,不能进行到底;
C.氯气与氢氧化钠反应为歧化反应;
D.依据n=CV判断.
解答 解;A.标准状况下Br2为液态,不能根据气体摩尔体积计算所占的体积,故A错误;
B.合成氨的反应是可逆反应,加入的氮气和氢气不能全部转化,加入0.5 mol N2和1.5 mol H2,充分反应后得到的NH3分子数小于NA,故B正确;
C.氯气和碱反应是自身氧化还原反应,0.3 mol氯气反应转移0.3 mol电子,故C正确;
D.依据n=CV可知,当溶液体积合适时,NH4Cl溶液中阳离子的数目可以为NA,故D正确;
故选:A.
点评 本题考查阿伏伽德罗常数,物质的量的有关计算,解题时注意使用气体摩尔体积时标准状况下的要求及物质所处的状态,注意可逆反应不能进行到底的特点,题目难度不大.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 该电池放电时,通入肼的一极为负极 | |
| B. | 电池每释放1molN2转移的电子数为4NA | |
| C. | 电池工作一段时间后,电解质溶液的pH将不变 | |
| D. | 通入空气的一极的电极反应式是:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
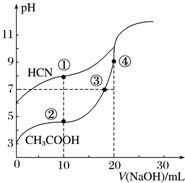 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①和点②所示溶液中:c(CH3COO-)<c(CN-) | |
| B. | 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20.00mL 0.1mol•L-1的MOH溶液中逐滴加入一定浓度的HA溶液.滴加过程中,溶液的pH与滴入HA溶液的体积关系如图所示,当pH=8时MOH溶液恰好被中和.则下列说法中错误的是( )
常温下,向20.00mL 0.1mol•L-1的MOH溶液中逐滴加入一定浓度的HA溶液.滴加过程中,溶液的pH与滴入HA溶液的体积关系如图所示,当pH=8时MOH溶液恰好被中和.则下列说法中错误的是( )| A. | ②点混合溶液中水电离出的c(H+)大于酸HA溶液中由水电离出的c(H+) | |
| B. | ③点混合溶液中各离子浓度的大小关系是c(M+)=c(A-)>c(H+)=c(OH-) | |
| C. | 酸HA溶液的浓度为0.1 mol•L-1 | |
| D. | ④点溶液中,存在c(HA)+c(H+)>c(M+)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 8种 | C. | 16种 | D. | 24种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
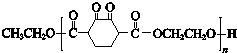 )是人造棉的主要成分之一,合成路线如下:
)是人造棉的主要成分之一,合成路线如下: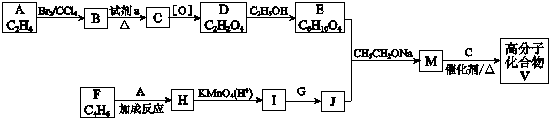
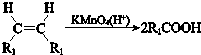
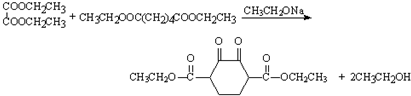
 (R、R1、R2、R3表示烃基)
(R、R1、R2、R3表示烃基)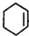 .
. .
.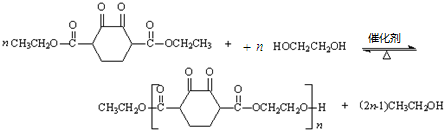 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
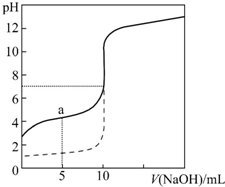 常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1mol•L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示.下列说法错误的是( )
常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1mol•L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示.下列说法错误的是( )| A. | 图中虚线表示NaOH溶液滴定盐酸时的pH变化 | |
| B. | 酸溶液的体积均为10 mL | |
| C. | a点:c(CH3COO-)>c(CH3COOH) | |
| D. | 当pH=7时,滴定醋酸消耗的V(NaOH)=10 mL,且c(CH3COO-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeI2与足量的氯气反应转移电子数为2NA | |
| B. | 标准状况下22.4L一氯甲烷和二氯甲烷的混合物中所含氯原子数介于NA至2NA之间 | |
| C. | 0.1molCu与足量热的浓硫酸反应生成的SO2体积标准状况下约为2.24L | |
| D. | 0.2mol/L的Na2S溶液中,所含S2-数目小于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
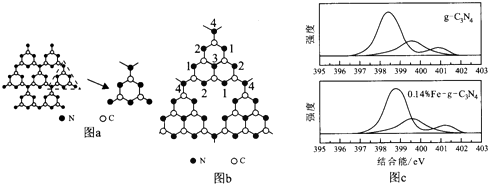
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com