
| A. | 1molFeI2与足量的氯气反应转移电子数为2NA | |
| B. | 标准状况下22.4L一氯甲烷和二氯甲烷的混合物中所含氯原子数介于NA至2NA之间 | |
| C. | 0.1molCu与足量热的浓硫酸反应生成的SO2体积标准状况下约为2.24L | |
| D. | 0.2mol/L的Na2S溶液中,所含S2-数目小于0.2NA |
分析 A.碘化亚铁与足量氯气反应生成碘单质和氯化铁;
B.二氯甲烷为液体不能使用标况下的气体摩尔体积计算混合物的物质的量;
C.Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,据此解答;
D.溶液体积未知.
解答 解;A.1molFeI2与足量的氯气反应转移电子数为3NA,故A错误;
B.二氯甲烷标准状况下为液态,无法计算混合气体中含有的氯原子的范围,故B错误;
C.Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,可知0.1mol铜与足量硫酸反应生成0.1mol二氧化硫,标准状况下约为2.24L,故C正确;
D.溶液体积未知,无法计算硫离子个数,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1.0mol/L的硝酸钾溶液中:Mg2+,Fe2+、Cl-、SO42- | |
| B. | 由水电离的c(H+)=1.0×10-13mol/L的溶液中:Ca2+,K+、Br-、HCO3- | |
| C. | 在pH=1的溶液中:NH4+、Na+、ClO-、Cl- | |
| D. | 无色溶液中:Al3+、Na+、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.5NA个Br2分子所占的体积为11.2 L | |
| B. | 在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后得到的NH3分子数小于NA | |
| C. | 标准状况下,6.72 L Cl2与足量的NaOH溶液反应,转移的电子数为0.3NA | |
| D. | 在0.1 mol•L-1NH4Cl溶液中阳离子的数目可能为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g O2和32g O3的混合物中,含有O原子数月为3NA | |
| B. | 标准状况下,1mol Na2O和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1 mol NaBH4中离子键的数目为2NA | |
| D. | 在K35ClO3+6H37Cl═KCl+3Cl2↑+3H2O中,若生成71 g Cl2,转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
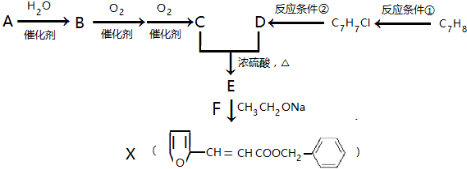
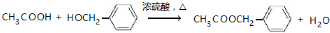
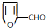 ,其最多有11个原子共平面.
,其最多有11个原子共平面.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
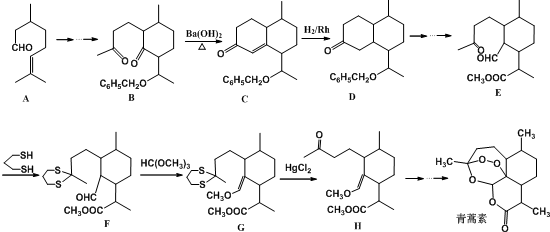
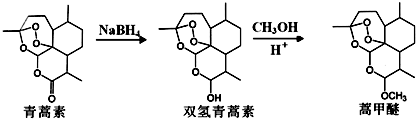
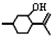 ,则异蒲勒醇分子有3个手性碳原子(连有四种不同原子或原子团的碳原子称为手性碳原子).异蒲勒醇可通过两步反应生成
,则异蒲勒醇分子有3个手性碳原子(连有四种不同原子或原子团的碳原子称为手性碳原子).异蒲勒醇可通过两步反应生成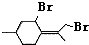 ,请写出相关化学反应方程式
,请写出相关化学反应方程式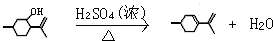 ,
,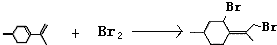 .
.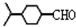 .(填结构简式)
.(填结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 试验 | CH4与Cl2的取代反应 | 检验石蜡油分解产生的烯烃 | 制备乙酸乙酯 | 检验蔗糖是否在稀硫酸作用下水解 |
| 装置仪器或试剂 | 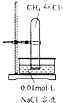 | 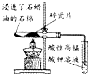 |  | 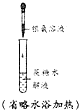 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com