
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=___kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=___kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有___。
A.使用过量的CO B.升高温度 C.增大压强
(3)以下说法能说明反应3H2(g)+3CO(g) ![]() CH3OCH3(g)+CO2(g) 达到平衡状态的有______。
CH3OCH3(g)+CO2(g) 达到平衡状态的有______。
A.H2和CO2的浓度之比为3:1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应: C(s)+CO2(g) ![]() 2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。
①该反应H_____0(填“>”、“<”或“=”),550℃时,平衡后若充入惰性气体,平衡_____(填“正移”、“逆移“或“不移动" )。
②)650℃时,反应达平衡后CO2的转化率为_____(保留2位有效数字)。
③T℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=_____P总.
【答案】 -246.1 AC DE > 正移 25% 0.5
【解析】(1).已知合成二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g)△H1=-90.7 kJ·mol-1
CH3OH(g)△H1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)△H2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g)△H3=-41.2kJ·mol-1
CO2(g)+H2(g)△H3=-41.2kJ·mol-1
由盖斯定律可知,通过①×2+②+③可得所求反应方程式3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),则△H=2△H1+△H2+△H3=246.1kJ/mol,故答案为:241.6;
CH3OCH3(g)+CO2(g),则△H=2△H1+△H2+△H3=246.1kJ/mol,故答案为:241.6;
(2). A. 增大反应物的浓度平衡正向移动,所以使用过量的CO,能提高CH3OCH3产率,故A正确;
B. 该反应为放热反应,升高温度平衡逆向移动,则CH3OCH3产率会降低,故B错误;
C. 该反应正方向为体积减小的方向,所以增大压强平衡正向移动,能提高CH3OCH3产率,故C正确;
故答案为:AC;
(3)A.H2和CO2的浓度之比为3:1,并不能说明正逆反应速率是否相等,所以不能说明该反应达到平衡状态,故A错误;
B.单位时间内断裂3个H-H同时断裂1个C=O,表示的都是正向速率,不能说明正逆反应速率相等,故B错误;
C.恒温恒容条件下,气体的密度保持不变,因该反应的气体总质量和容器体积均不变,则气体的密度始终不变,所以不能说明达到平衡状态,故C错误;
D.恒温恒压条件下,气体的平均摩尔质量保持不变,因该反应的气体总质量不变,但气体的总物质的量发生改变,则气体的平均摩尔质量不变,可以说明该反应达到了平衡状态,故D正确;
E.因该反应为放热反应,则在绝热体系中,体系的温度保持不变,说明达到了平衡状态,故E正确;
故答案选DE;
(4).①.由题意和图分析可知,图中上升的曲线表示的是CO,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,在T℃后,随温度升高,一氧化碳百分数增大,二氧化碳百分数减小,则平衡正向移动,升温平衡向吸热反应方向移动,所以正反应为吸热反应,故△H>0;
550℃时,在体积可变的恒压密闭容器中,平衡后若充入惰性气体,相当于减小压强,则平衡正向移动;
故答案为:>;正移;
②.由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,反应转化了xmol,
则有C(s)+CO2(g)2CO(g)
起始 1 0
转化 x 2x
平衡; 1x 2x
所以2x/(1x+2x)×100%=40%,解得x=0.25mol,则CO2的转化率为![]() ×100%=25%,故答案为25%;
×100%=25%,故答案为25%;
③.T℃时,CO和CO2的体积分数都为50%,所以用平衡分压代替平衡浓度表示的化学平衡常数Kp=![]() = 0.5P总,故答案为:0.5;
= 0.5P总,故答案为:0.5;


科目:高中化学 来源: 题型:
【题目】某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下。

已知:①部分离子生成氢氧化物沉淀的pH如下表所示。
②Ni( OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
(1)步骤(a)中Ni和浓硝酸反应的化学方程式为__________________________________。
(2)步骤(b)首先加入试剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是____________________________________________。
②试剂X可以是___________________(填标号)。
A. H2SO4 B.Ni(OH)2 C.NaOH D.Fe2O3 E.NiO
(3)NH3含量的测定
i.用电子天平称量mg产品于锥形瓶中,用25 mL水溶解后加入3.00 mL6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.5000 mol/L NaOH标准溶液V1mL;
ii.空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
①NH3的质量分数为___________________________。
②在上述方案的基础上,下列措施能进一步提高测定准确度的有___________(填标号)。
A.适当提高称量产品的质量 B.用H2SO4溶液替代盐酸
C.用酚酞替代甲基橙 D.进行平行试验
(4)为测定Cl的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25 mL水溶解,___________________________________,滴入2—3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2-3次。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的酸性K2Cr2O7水溶液遇乙醇迅速生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇的沸点低②乙醇的密度比水小③乙醇有还原性④乙醇是烃的含氧衍生物
A.②④B.①③C.②③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CH3OH(g) + NH3(g)![]() CH3NH2(s) + H2O(g)在高温下才能自发向右进行,则该反应的ΔH、ΔS应为( )
CH3NH2(s) + H2O(g)在高温下才能自发向右进行,则该反应的ΔH、ΔS应为( )
A.ΔH>0、ΔS<0
B.ΔH<0、ΔS>0
C.ΔH>0、ΔS>0
D.ΔH<0、ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,下列叙述正确的是( ) 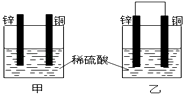
A.装置甲中铜片表面产生气泡
B.装置甲溶液中SO42ˉ向铜片做定向移动
C.装置乙中电子从铜片经导线流向锌片
D.装置乙中正极的电极反应式:2H++2eˉ═H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下各种模型图都由C、H、O、N中的一种或多种元素构成。下列说法正确的是( )

A. 图①是球棍模型,其化学式为:C3H7O2N,是一种蛋白质
B. 图②是比例模型,其化学式为:C9H13NO,该物质既能与盐酸反应,又能与氢氧化钠溶液反应
C. 图③是球棍模型,其化学式为:C9H10O3,1 mol该物质能消耗3 mol氢氧化钠
D. 图③是比例模型,其化学式为:C9H13ON,能够发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体里有机污染物降解的高级氧化技术。其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2![]() Fe3++OH- +·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法不正确的是
Fe3++OH- +·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法不正确的是

A.电源的A极是负极
B.电解池中只有O2、Fe3+发生还原反应
C.阳极上发生电极反应:H2O-e-![]() ·OH + H+
·OH + H+
D.消耗1molO2,可以产生4mol ·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知;还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图。下列说法正确的是()

A.反应过程中的氧化产物均为Na2SO4
B.a 点时消耗NaHSO3的物质的量为1.0mol
C.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
D.当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com