
����Ŀ����84����Һ����1984�걱��ijҽԺ����ʹ�ö����������ճ�������ʹ�ù㷺������Ч�ɷ���NaClO��ij��ѧ�о���ѧϰС����ʵ�����Ʊ�NaClO��Һ������������̽���ͳɷֲⶨ��

��1����ѧϰС�鰴��ͼװ�ý���ʵ��(���ּг�װ��ʡȥ)����Ӧһ��ʱ��ֱ�ȡB��Cƿ�е���Һ����ʵ�飬ʵ���������±���
��֪��1������NaClO��ҺpHΪ1l��2��25��Cʱ��������볣��Ϊ��H2CO3��K1=4.4��10��7��K2=4.7��10��11��HCO��K=3��10��8
ʵ�鲽�� | ʵ������ | |
Bƿ | Cƿ | |
ʵ��1��ȡ�����μ���ɫʯ����Һ | ��죬����ɫ | ����������ɫ |
ʵ��2���ⶨ��Һ��pH | 3 | 12 |
�ش��������⣺
������a������_______��װ��A�з�����Ӧ�����ӷ���ʽ_____��
��Cƿ��Һ�е�������NaCl��______(�ѧʽ)��
������Cƿ��Һ���� NaHCO3��Һ�������������������ʵ�飬Cƿ����Ϊ��ʵ��1����ɫʯ����Һ������ɫ��ʵ��2����Һ��pH=7�����ƽ���ƶ�ԭ��������ɫʯ����Һ������ɫ��ԭ��_______��
��2���ⶨCƿ��Һ��NaClO����(��λ��g)��ʵ�鲽�����£�
��ȡCƿ��Һ20ml����ƿ�У����������ữ���������KI��Һ���ǽ�ƿ�����ڰ�����ַ�Ӧ��
����0.1000mol/LNa2S2O3����Һ�ζ���ƿ�е���Һ��ָʾ����ʾ�յ���ظ�����2~3�Σ�Na2S2O3��Һ��ƽ������Ϊ24.00ml��(��֪��I2+2S2O32��=2I��+S4O62��)
�ٲ���I��Cƿ�з�����Ӧ�����ӷ���ʽΪ______��
��ͨ��ѡ��______��ָʾ�����ζ����յ������______��
��Cƿ��Һ��NaClO����Ϊ_______g/L(����2λС��)
���𰸡���Һ©�� ![]() NaClO��NaOH Cƿ��Һ�д���ƽ��Cl2��H2O
NaClO��NaOH Cƿ��Һ�д���ƽ��Cl2��H2O![]() HCl��HClO��HCO3-����H+��ʹƽ�����ƣ�HClO��Ũ��������HClO����Ư���ԣ�ʹ��ɫʯ��������ɫ ClO-+2I-+2H+=I2+Cl-+H2O ������Һ ���������һ��Na2S2O3��Һ����Һ����ɫ��Ϊ��ɫ���Ұ���Ӳ���ɫ 4.47
HCl��HClO��HCO3-����H+��ʹƽ�����ƣ�HClO��Ũ��������HClO����Ư���ԣ�ʹ��ɫʯ��������ɫ ClO-+2I-+2H+=I2+Cl-+H2O ������Һ ���������һ��Na2S2O3��Һ����Һ����ɫ��Ϊ��ɫ���Ұ���Ӳ���ɫ 4.47
��������
��1��A����ȡCl2װ�ã�B������HClװ�ã�C����ȡNaClOװ�ã�D������Cl2װ�á�Cl2��ˮ�д��ڿ�����̣�Cl2+H2O![]() HCl+HClO���ݴ˷���ƽ���ƶ�������
HCl+HClO���ݴ˷���ƽ���ƶ�������
��2��NaClO��������������KI��Һ����������ԭ��Ӧ��+1��Cl����ԭΪ-1�ۣ�-1��I������Ϊ0�ۣ�HClO������������ֽ�����HCl��O2�����Ըǽ�ƿ�����ڰ�����ַ�Ӧ����������������ζ��յ�Ҫ������ڲ��ָ�ԭ������ɫ��
��1��������aΪ��Һ©������Ũ������MnO2��Cl2����Ӧ�����ӷ���ʽΪ��![]() ����Ϊ����Һ©����
����Ϊ����Һ©����![]() ��
��
��Cl2��NaOH��Һ��Ӧ����NaClO��NaCl��NaOH����������Cƿ��Һ����������NaCl��NaClO��NaOH����Ϊ��NaClO��NaOH��
������Cƿ��Һ���� NaHCO3��Һ��Cl2����ˮ����ƽ��Cl2��H2O![]() HCl��HClO��HCO3-����H+��ʹƽ�����ƣ�HClO��Ũ��������HClO����Ư���ԣ�ʹ��ɫʯ��������ɫ����Ϊ��Cƿ��Һ�д���ƽ��Cl2��H2O
HCl��HClO��HCO3-����H+��ʹƽ�����ƣ�HClO��Ũ��������HClO����Ư���ԣ�ʹ��ɫʯ��������ɫ����Ϊ��Cƿ��Һ�д���ƽ��Cl2��H2O![]() HCl��HClO��HCO3-����H+��ʹƽ�����ƣ�HClO��Ũ��������HClO����Ư���ԣ�ʹ��ɫʯ��������ɫ��
HCl��HClO��HCO3-����H+��ʹƽ�����ƣ�HClO��Ũ��������HClO����Ư���ԣ�ʹ��ɫʯ��������ɫ��
��2����NaClO��������������KI��Һ����������ԭ��Ӧ��+1��Cl����ԭΪ-1�ۣ�-1��I������Ϊ0�ۣ���Ӧ���ӷ���ʽΪ��ClO-+2I-+2H+=I2+Cl-+H2O����Ϊ��ClO-+2I-+2H+=I2+Cl-+H2O��
�ڵ����������������ѡ�õ�����Һָʾ�յ㣬������ζ��յ㣬Na2S2O3������I2����Һ����ɫ����ɫ���Ұ�����ڲ���ɫ����Ϊ��������Һ�����������һ��Na2S2O3��Һ����Һ����ɫ��Ϊ��ɫ���Ұ���Ӳ���ɫ��
��NaClO~HClO~I2~2S2O32��������n(NaClO)=![]() n(S2O32��)=
n(S2O32��)=![]() ��0.1000mol��L��1��0.024 L =0.0012mol��m(NaClO)=0.0012mol��74.5gmol-1=0.0894g�����Cƿ��Һ��NaClO�ĺ���Ϊ��0.0894g��0.02L=4.47g��L-1����Ϊ��4.47��
��0.1000mol��L��1��0.024 L =0.0012mol��m(NaClO)=0.0012mol��74.5gmol-1=0.0894g�����Cƿ��Һ��NaClO�ĺ���Ϊ��0.0894g��0.02L=4.47g��L-1����Ϊ��4.47��


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ�ü�ҩƷ������Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ���

A.ͼ1 ����
B.ͼ2 ���뱽�����Ȼ�̼�Ļ����
C.ͼ3 ��ȥFe(OH)3�����е�FeCl3��Һ
D.ͼ4 ��ȡʱ��ҡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ۼ��Ķ����о��Ѻ��������ַ�ʽ�������ѣ�AB�D��A![]() �����ѣ�AB�D��A����[B]�������л�ѧ��Ӧ�з������ۼ����ѵ���(����)
�����ѣ�AB�D��A����[B]�������л�ѧ��Ӧ�з������ۼ����ѵ���(����)
A. 2K��2H2O===2KOH��H2��
B. 2Na��2C2H5OH�D��2C2H5ONa��H2��
C. Na2CO3��H2O![]() NaHCO3��NaOH
NaHCO3��NaOH
D. CH3COOH��C2H5OH![]() H2O��CH3COOC2H5
H2O��CH3COOC2H5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾһЩ�����е�ijЩ�ṹ�����Ƿֱ���NaCl��CsCl���ɱ������ʯ��ʯī�ṹ�е�ijһ�ֵ�ijһ���֡�
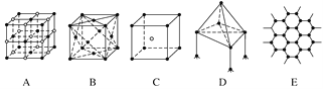
��1�����д������ʯ����(������ĸ����ͬ)____������ÿ��̼ԭ����______��̼ԭ����ӽ��Ҿ�����ȡ����ʯ����________���塣
��2�����д���NaCl����________��ÿ��Na����Χ������ӽ��Ҿ�����ȵ�Na����________����
��3�������ɱ�����________��������________���壬ÿ��CO2������______��CO2���ӽ��ڡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����ʵ�ֵ���

A. װ�âٿɼ��������鷢����ȥ��Ӧ�õ�������Ϊ��ϩ
B. װ�â��е�CuSO4��Һ�����ڳ�ȥ����
C. װ�â�a���к�ɫ�������ɣ�b��������֤��Xһ����H2
D. װ�âܿ�����ʵ������ȡ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Al��Cl��Cr��Ni�ȼ�����ػ�������;�dz��㷺���ش��������⣺
��1����̬��ԭ�ӵļ۵����Ų�ʽΪ______��
��2�����ԭ��δ�ɶԵ�������ͬ�ĵ�������Ԫ�ع���______�֣�����������ͬ���ڣ������۷е㼰Ӳ�Ⱦ����ƴ���ԭ����______��
��3��KAlO2��ˮ��Һ��ʵ���϶�����K[Al(OH)4]��ʽ���ڡ�����[Al(OH)4]-�����ӣ�����ԭ�ӵ��ӻ�������____����K[Al(OH)4]�����д��ڵĻ�ѧ������λ����_____(����ĸ����)��
A�����Ӽ� B�����Լ� C���Ǽ��Լ� D�������� E�����
��4��CN2��Ϊ��������������±�ص������ơ�������������Һ��Ӧ����֮һΪNaCN��д��������CN����Ϊ�ȵ�����ķ���_____��NԪ�ؼ�����ͬ�������ڵ�����Ԫ�ص�һ�������ɴ�С��˳��Ϊ______��(��Ԫ�ط���)
��5���Ȼ���۵㣺645�棬�е㣺1290�棻�Ȼ����۵㣺190�棬��180��ʱ��ʼ��������ɶ����ۡ��е����ϴ��ԭ����______����ͼΪ�Ȼ�菉�������֪�����Ӱ뾶Ϊanm������Ӱ뾶Ϊbnm�����Ȼ�菉����ܶ�Ϊ_____g��cm��3(��a��b�Ͱ����ӵ�����NA�Ĵ���ʽ��ʽ���г���ʽ����)

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ�ӻ��ȡ������ܡ����ܵĵ�λ����kJmol��1

������˵����ȷ����
A. Na��s����Cl2��g����Ӧ����1mol NaCl��s���ų�������Ϊ556.1kJ
B. Si��s��+2Cl2��g���TSiCl4��g����H=��602kJmol��1
C. �ӱ��п��Կ������Ȼ��Ƶ��۵�Ⱦ�����
D. �ӱ������ݿ��Կ��������뾶Խ������������Ӽ�Խ���������ۼ�ȴԽǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ���ܺ���Na����Ca2+��NO��CO![]() ��SO
��SO![]() ��Cl�������ӡ�Ϊ�˼�����Щ���ӣ��ֱ�ȡ������Һ��������ʵ�飺
��Cl�������ӡ�Ϊ�˼�����Щ���ӣ��ֱ�ȡ������Һ��������ʵ�飺
�ټ�ϡ�����������ɫ��ζ�����壬��������ʹ����ʯ��ˮ����ǡ�
�ڼ�������BaCl2������ɫ���������ˣ��ڳ����м������������ᣬ����������ȫ�ܽ⡣
��ȡ������Һ���������ữ���ټӹ�����AgNO3��Һ��������ɫ������
��1������3��ʵ��֤��һ�����ڵ�������__________��һ�������ڵ�������________�����ܴ��ڵ�����Ϊ_______________��
��2��д�������漰��Ӧ�����ӷ�Ӧ����ʽ: _____________________________��
��3��ʵ�����г����ڼ���Na���Ƿ���ڵķ�����___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO(g)+ 2H2(g)![]() CH3OH(g) ��H
CH3OH(g) ��H
��1����֪CO(g)��H2(g)�ı�ȼ���ȷֱ�Ϊ-285.8kJmol-1��-283.0kJmol-1����CH3OH(g)+3/2O2(g)![]() CO2(g)+2H2O(l) ��H=��761 kJmol-1����CO(g)+ 2H2(g)
CO2(g)+2H2O(l) ��H=��761 kJmol-1����CO(g)+ 2H2(g)![]() CH3OH(g)�ġ�H= ___________��
CH3OH(g)�ġ�H= ___________��
��2����Ӧ�Ħ�S_______0�������������������������________����ϸߡ��ϵ͡����¶��¸÷�Ӧ�Է����С�
��3�����������ʵ�����CO��H2������������º����ܱ������н���������Ӧ��������ʵ��˵���˷�Ӧ�Ѵﵽƽ��״̬����_______________��
A�������������ܶȱ��ֲ��� B����������ƽ����Է�����������
C������CH3OH������������H2��������� D��CO������������ֲ���
��4����ͼ������ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ������Ϊ__________����a��b��ʾ����

��5��Ͷ�ϱ�n(H2)/n(CO)=2ʱ����ϵ��CO��ƽ��ת����(��)�¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ����(CO)ֵ���¶����߶�___________�������С������ԭ����___________________________����ͼ�е�ѹǿ�ɴ�СΪ__________________����P1��P2��P3��ʾ����

��6��520Kʱ�� Ͷ�ϱ�n(H2)/n(CO)=2�������ʵ���Ϊ3mol����ά�ַ�Ӧ������ѹǿP3���䣬�ﵽƽ��ʱ����������Ϊ0.1L����ƽ�ⳣ��K=_______����H2��CO�����ʵ���֮��Ϊn��1��ά�ַ�Ӧ������ѹǿP3���䣩����Ӧƽ����ϵ��CH3OH�����ʵ�������Ϊx��������ͼ�л���x��n�仯��ʾ��ͼ_______��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com