
【题目】(1)泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈_________(填酸性、碱性、中性),原因(用离子方程式解释)_________________________________________;灭火器中另一容器装有Al2(SO4)3溶液,该溶液呈__________(填酸性、碱性、中性),原因(用离子方程式释)______________________________________当意外失火时,使泡沫灭火器倒过来即可使药液混合,喷出CO2和Al(OH) 3,阻止火势蔓延。原因(用离子方程式解释)__________________________________________
(2)已知25℃,AgI的饱和溶液中,c(Ag+)=1.22×10-8mol/L,AgCl的饱和溶液中,c(Ag+)=1.25×10-5mol/L。若在5ml含有KCl和KI各为0.01mol/L的溶液中,加入8ml 0.01mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度由大到小的次序是_________________________________________
(3)在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中充分反应,达到平衡后,测得c(H2)=0.0080mol/L。该反应的平衡常数 K=_________;在上述温度下,该容器中若通入H2和I2蒸气各0.20mol,求达到化学平衡状态时c(H2)=___________ ,c(I2)=___________ ,c(HI)=____________
【答案】碱性 HCO3-+H2O ![]() H2CO3+OH- 酸性 Al3++3H2O
H2CO3+OH- 酸性 Al3++3H2O![]() Al(OH)3+3H+ 3HCO3-+Al3+=Al(OH)3↓+3CO2↑ C(K+)>C(NO3-)>C(Cl-)>C(Ag+)>C(I-) 0.25 0.016 mol/L 0.016 mol/L 0.0080 mol/L
Al(OH)3+3H+ 3HCO3-+Al3+=Al(OH)3↓+3CO2↑ C(K+)>C(NO3-)>C(Cl-)>C(Ag+)>C(I-) 0.25 0.016 mol/L 0.016 mol/L 0.0080 mol/L
【解析】
(1)碳酸氢钠在溶液中水解,使溶液呈碱性,硫酸铝在溶液中水解,使溶液呈酸性,碳酸氢钠和硫酸铝在水溶液中发生双水解反应生成二氧化碳气体和氢氧化铝沉淀;
(2)由题给溶度积可知,Ksp(AgI)<Ksp(AgCl),所以加入8ml 0.01mol/L AgNO3溶液,先生成AgI沉淀,再生成AgCl;
(3)由题给数据建立三段式,由平衡时各物质浓度计算平衡常数;温度不变平衡常数不变,由起始反应物的量建立三段式,再依据平衡常数计算平衡时各物质的物质的量浓度。
(1)碳酸氢钠是强碱弱酸盐,碳酸氢根离子在溶液中水解,使溶液呈碱性,水解离子方程式为:HCO3-+H2O ![]() H2CO3+OH-;硫酸铝是强酸弱碱盐,铝离子在溶液中水解,使溶液呈酸性,Al3++3H2O
H2CO3+OH-;硫酸铝是强酸弱碱盐,铝离子在溶液中水解,使溶液呈酸性,Al3++3H2O ![]() Al(OH)3+3H+,碳酸氢钠和硫酸铝在水溶液中发生双水解反应生成二氧化碳气体和氢氧化铝沉淀,反应的离子方程式为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑,故答案为:HCO3-+H2O
Al(OH)3+3H+,碳酸氢钠和硫酸铝在水溶液中发生双水解反应生成二氧化碳气体和氢氧化铝沉淀,反应的离子方程式为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑,故答案为:HCO3-+H2O ![]() H2CO3+OH-;Al3++3H2O
H2CO3+OH-;Al3++3H2O![]() Al(OH)3+3H+;3HCO3-+Al3+=Al(OH)3↓+3CO2↑;
Al(OH)3+3H+;3HCO3-+Al3+=Al(OH)3↓+3CO2↑;
(2)由题给溶度积可知,Ksp(AgI)<Ksp(AgCl),所以加入8ml 0.01mol/L AgNO3溶液,先生成AgI沉淀,再生成AgCl,由反应AgNO3+KI═AgI↓+KNO3可知,溶液中n(KI)=0.01molL-1×0.005 L=5.0×10-5mol,消耗n(AgNO3)=5.0×10-5mol,由反应AgNO3+KCl═AgCl↓+KNO3可知,过量的AgNO3为0.01 molL-1×0.008 L-5.0×10-5mol=3.0×10-5mol,而KCl为n(KCl)=0.01molL-1×0.005 L=5.0×10-5mol,则溶液中KCl过量,生成AgCl为3.0×10-5mol,反应后溶液中的溶质为KNO3、KCl,n(KNO3)=n(AgNO3)=0.01 molL-1×0.008 L=8×10-5mol,n(KCl)=5.0×10-5mol,根据物料守恒得离子浓度大小顺序是:c(K+)>c(NO3-)>c(Cl-),溶液中还存在氯离子,所以银离子浓度较小,碘化银溶度积常数最小,所以碘离子浓度最小,所以离子浓度大小顺序为:c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),故答案为:c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-);
(3)达到平衡时,测得c(H2)=0.0080mol/L,则由题给数据建立如下三段式:
H2(g)+I2(g)![]() 2HI(g)
2HI(g)
起始量(mol/L) 0.010 0.010 0
变化量(mol/L) 0.0020 0.0020 0.0040
平衡量(mol/L) 0.0080 0.0080 0.0040
平衡时c(H2)=c(I2)=0.0080mol/L,c(HI)=0.0040mol/L,则K=![]() =0.25,故答案为:该反应的平衡常数为0.25;
=0.25,故答案为:该反应的平衡常数为0.25;
此温度下,起始量分别是c(H2)=0.02mol/L、c(I2)=0.02mol/L,设H2反应的消耗量为x,由此建立三段式:
H2(g)+I2(g)![]() 2HI(g)
2HI(g)
起始量(mol/L) 0.020 0.020 0
变化量(mol/L) x x 2x
平衡量(mol/L) (0.020—x)(0.0020—x) 2x
因温度不变,平衡常数不变,由K=![]() ,解得x=0.0040 mol/L,则平衡时c(HI)=0.0080 mol/L,c(H2)=0.016mol/L;c(I2)=0.016mol/L,故答案为: 0.016mol/L;.016mol/L;0.0080 mol/L。
,解得x=0.0040 mol/L,则平衡时c(HI)=0.0080 mol/L,c(H2)=0.016mol/L;c(I2)=0.016mol/L,故答案为: 0.016mol/L;.016mol/L;0.0080 mol/L。


科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1![]() 氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是
氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是

A. 常温下,0.1![]() 氨水中
氨水中![]() 的电离常数K约为
的电离常数K约为![]()
B. a、b之间的点一定满足,![]()
C. c点溶液中![]()
D. d点代表两溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。根据题意完成下列问题:
CH3OH(g)。根据题意完成下列问题:

(1)反应达到平衡时,平衡常数表达式K=__________,升高温度,K值________(填“增大”“减小”或“不变”),平衡向__________方向移动。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v(H2)____________________。(用含相应字母的式子表示)
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是________(填选项字母)。
A.氢气的浓度减小 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线。下列叙述正确的是
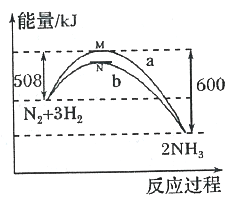
A. 状态M和N均表示2molN(g)+6mol H(g)
B. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-l
2NH3 △H=-92kJ·mol-l
C. 使用催化剂,降低了反应进行所需的最低能量,增大了反应放出的能量
D. 使用催化剂,并不能改变反应的△H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时, 在一个2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)该反应的化学方程式为 _____________________________。
(2)反应开始至2 min,以气体Z表示的平均反应速为 ___________________________。
(3)若X、Y、Z均为气体,2 min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的_____________倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时 ___(填”增大”“减小”或”相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=a的某电解质溶液中,插入两支惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是
A. Na2SO4 B. H2SO4 C. AgNO3 D. NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3X(g)+Y(g) ![]() Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
(1)升高温度:____________;
(2)增大压强:____________;
(3)增大容器容积:______________;
(4)加入X:______________;
(5)加入Y:______________;
(6)压缩体积:______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
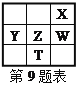
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com