
����Ŀ����һ���¶�ʱ��N2��H2��Ӧ�����������仯��������ͼ������a��ʾ��ʹ�ô���ʱ�������仯���ߣ�b��ʾʹ�ô���ʱ�������仯���ߡ�����������ȷ����
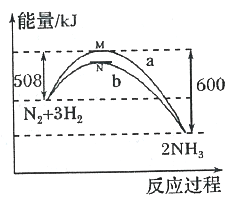
A. ״̬M��N����ʾ2molN(g)+6mol H(g)
B. �÷�Ӧ���Ȼ�ѧ����ʽΪ��N2+3H2![]() 2NH3 ��H=-92kJ��mol-l
2NH3 ��H=-92kJ��mol-l
C. ʹ�ô����������˷�Ӧ�����������������������˷�Ӧ�ų�������
D. ʹ�ô����������ܸı䷴Ӧ�ġ�H
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���������ȱ����ƶѪ�����ʽϸߵĹ���֮һ��2004���ҹ��������Ѿ���������ǿ��������Ŀ���ƹ���ǿ�����ͣ����������ָ( )
A. Ԫ�� B. ����
C. ԭ�� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2SO2(g)+O2(g) ![]() 2SO3(g) ��H=-197kJmol-1����ͬ�¡�ͬ����������ܱ������зֱ�������壺(��) 2mol SO2��1mol O2��(��) 1mol SO2��0.5mol O2��(��) 2mol SO3�����¡������·�Ӧ��ƽ��ʱ�����й�ϵһ����ȷ����
2SO3(g) ��H=-197kJmol-1����ͬ�¡�ͬ����������ܱ������зֱ�������壺(��) 2mol SO2��1mol O2��(��) 1mol SO2��0.5mol O2��(��) 2mol SO3�����¡������·�Ӧ��ƽ��ʱ�����й�ϵһ����ȷ����
A��������ѹǿP��P��=P����2P��
B��SO3������m��m��=m����2m��
C��c(SO2)��c(O2)֮��k��k��=k����k��
D����Ӧ�ų���������������ֵQ��Q��=Q����2Q��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣�X��Y��Z��W��Ϊ������Ԫ�أ�ZԪ��ԭ���������������������֮��Ϊ1��3��������˵����ȷ����

A. ԭ�Ӱ뾶��СΪW>Z>Y>X
B. W����ۺ������������ǿ
C. X��Z��Y��W�����{���۷ֱ�Ϊ+4��+5��+6��+7
D. Z��W�γɵ����л�������.ԭ���������Ӿ��ﵽ8e-�ȶ��ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������и������ʰ��ᡢ��ε�˳��������ȷ���ǣ� ��
A.���ᡢ���ʯ��
B.�����ᡢ�ռ�̷�
C.���ᡢ�Ҵ���������
D.���ᡢ��ʯ�ҡ����Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ��Ը�������Ҫ�ɷ�Ϊ�Ǹ�������FeCr2O4��������Al2O3��SiO2�����ʣ�Ϊ��Ҫԭ�������췯�ƣ�Na2Cr2O7����ijʵ��С��ģ������������ͼ��ʾ��
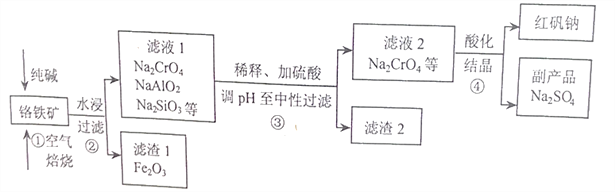
��1��FeCr2O4��Cr�Ļ��ϼ�Ϊ____________������ٱ���ʱ���õ���������Ϊ_________�������������Na2CrO4�Ļ�ѧ����ʽΪ________________________��
��2����������շ�Ӧ��������Ҫ���������������״̬����Ӧ���ʲżӿ죬����Ҫԭ��Ϊ________��
��3������ڹ���ʱ���õ��IJ���������________________��
��4������������Ὣ��Һ��pH�������ԣ���������2����Ҫ�ɷ���__________��__________��
��5�����������Һ2���������ữ�����У���Һ�ɻ�ɫ��Ϊ��ɫ����Ӧ�����ӷ���ʽΪ___________��
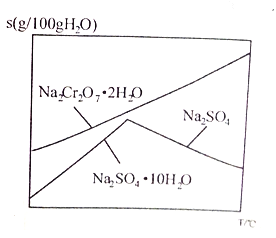
��6����ͼ��Na2Cr2O7��2H2O��Na2SO4���ܽ�����ߣ�������л�ø���ƷNa2SO4��ʵ���������Ϊ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���谢���ӵ���������ֵΪ������������ȷ���ǣ� ��
A.��״���£�22.4L���Ȼ�̼���еķ�����ΪNA
B.1 mol������������������ĵ����Ϊ2NA
C.0.5 molL��1NaOH��Һ�� Na+��Ϊ0.5NA
D.���³�ѹ�£�16g��������������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����������һ����̼�ڴ����������³�ַ�Ӧ�����ɵ����Ͷ�����̼������õ����Ͷ�����̼�����ʵ���֮��Ϊ1��2����õ�����������( )
A��N2O B��NO
C��NO2 D��N2O5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������ȷ���ǣ�
A. ʯ���ѽ⡢ú�ĸ��������ƴ��������ʵı��Ժ����������ӵľۼ����ǻ�ѧ�仯
B. Fe(OH)3������ɫ�������ܷ������������
C. Ư�ۡ�ˮú������ˮ�������Ϊ�����
D. Ũ��ˮ�еμ�FeCl3������Һ���Ƶ�Fe(OH)3����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com