
【题目】某氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。若测得氮气和二氧化碳的物质的量之比为1∶2,则该氮的氧化物是( )
A.N2O B.NO
C.NO2 D.N2O5
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】I.(1)根据如图所示情况,判断下列说法中正确的是 。
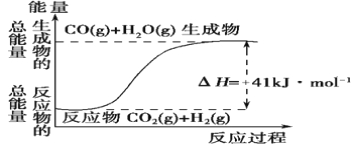
A.其热化学方程式为:CO(g)+ H2O(g)=CO2(g) + H2(g) ΔH=+41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是 。
(3)已知反应:N2(g) + O2 (g)=2NO(g) △H1
2H2(g)+ O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H4 的反应焓变为 (用含△H1、△H2、△H3的式子表示)。
(4)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:已知反应2HI(g) ![]() H2(g)+I2(g) 的△H=+11kJmol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
H2(g)+I2(g) 的△H=+11kJmol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线。下列叙述正确的是
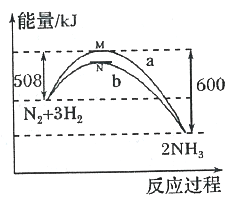
A. 状态M和N均表示2molN(g)+6mol H(g)
B. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-l
2NH3 △H=-92kJ·mol-l
C. 使用催化剂,降低了反应进行所需的最低能量,增大了反应放出的能量
D. 使用催化剂,并不能改变反应的△H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、二氧化碳、青霉素、硝酸钾、乙醇、氨等“分子”改变过人类的世界。
(1)铁原子在基态时,外围电子排布式为____________。
(2)CO2的电子式为____________,1 mol CO2分子中含有σ键的物质的量为____________。
(3)6-氨基青霉烷酸的结构如图所示:
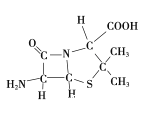
①其中C、N、O原子半径的大小关系为____________,电负性的大小关系为____________;
②其中采用sp3杂化的原子有C、____________。
(4)硝酸钾中NO3-的空间构型为____________,写出与NO3-互为等电子体的一种由前二周期元素原子构成的非极性分子化学式____________。
(5)乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是____________。
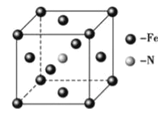
(6)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,若两个最近的Fe原子间的距离为a cm,则该晶体的密度计算式为____________g/cm3(用NA表示阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应CaCO3(s) = CaO (s)+CO2(g),下列说法中正确的是( )
A.△H < 0 B.△S < 0 C.高温下自发进行 D.一定不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为
A.-870.3 kJ/mol B.-571.6 kJ/mol
C.+787.0 kJ/mol D.-488.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应
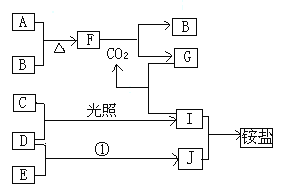
请回答下列问题:
(1)分別写出E、F的电子式:E________,F___________;
(2)实验室制J的化学方程式____________________________。
(3)由F制取B的反应中,每产生标准状况下11.2L的B,转移电子的物质的量为__________;
(4)在C、D、E.、I、J分子中,以极性键结合的是___________________ (填相应的字母,下同),以非极性键结合的是___________;
(5)用电子式表示I的形成过程__________________;
(6)现将标准状况下1.12 L二氧化碳通入60 mL 1 mol/L的A的最高价氧化物对应的水化物溶液中,则反应后溶液中溶质的物质的量之比为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上通过高温分解FeSO4的方法制备Fe2O3,化学方程式为:2FeSO4 ![]() Fe2O3+ SO3↑ + SO2↑为检验FeSO4高温分解的产物,进行如下实验:
Fe2O3+ SO3↑ + SO2↑为检验FeSO4高温分解的产物,进行如下实验:
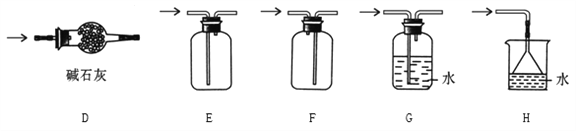
检验FeSO4高温分解产生的气体,将FeSO4高温分解产生的气体通入下图装置中。

① 装置A试管可选用的试剂是_________(填标号)。
a. 水 b. BaCl2溶液 c. Ba(NO3)2溶液 d. Ba(OH)2溶液
② 装置C的作用是防止尾气污染环境,试管中应加入的试剂是_________________。
③ 若装置B试管中溶液改为酸性KMnO4溶液,可以观察到溶液紫色褪去,反应的离子方程式为__________________________ 。
(2)工业上在一定温度和催化剂条件下用NH3将NO2还原生成N2,某同学在实验室中对NH3与NO2反应进行了探究。

①实验室可以用A、B或C装置制取氨气,如果用C装置,则该装置中烧瓶所盛放的试剂为________(写名称);反应的化学方程式是_____________________;
② 预收集一瓶干燥的氨气,选择下图中的装置,其气体收集和尾气处理装置连接顺序依次为:发生装置→_____________________(用字母表示)
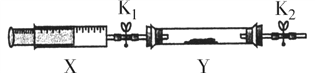
③ 将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按下图装置进行实验。打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中,Y管观察到的实验现象是____________________ ,反应的化学方程式为 ______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com