
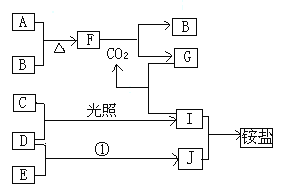
����Ŀ����ͼ�Dz��ֶ�����Ԫ�صĵ��ʼ��仯���������Һ����ת����ϵ����֪B��C��D��E�Ƿǽ��ʣ����ڳ��³�ѹ�¶������壻������G����ɫ��ӦΪ��ɫ��������I��Jͨ��״���³���̬����Ӧ���ǻ��������е�һ����Ҫ�̵���Ӧ
��ش��������⣺
��1���քeд��E��F�ĵ���ʽ��E________��F___________��
��2��ʵ������J�Ļ�ѧ����ʽ____________________________��
��3����F��ȡB�ķ�Ӧ�У�ÿ������״����11.2L��B��ת�Ƶ��ӵ����ʵ���Ϊ__________��
��4����C��D��E.��I��J�����У��Լ��Լ���ϵ���___________________ ������Ӧ����ĸ����ͬ�����ԷǼ��Լ���ϵ���___________��
��5���õ���ʽ��ʾI���γɹ���__________________��
��6���ֽ���״����1.12 L������̼ͨ��60 mL 1 mol/L��A������������Ӧ��ˮ������Һ�У���Ӧ����Һ�����ʵ����ʵ���֮��Ϊ_________________��
���𰸡� ![]()
![]() 2NH4Cl + Ca(OH)2 =��=CaCl2 + 2NH3��+ 2H2O 1mol I��J C��D��E
2NH4Cl + Ca(OH)2 =��=CaCl2 + 2NH3��+ 2H2O 1mol I��J C��D��E ![]() n(Na2CO3) �U n(NaHCO3) = 1�U4
n(Na2CO3) �U n(NaHCO3) = 1�U4
���������ڳ��³�ѹ�£�A�ǹ��壬B��C��D��E�Ƿǽ��������Ҷ������壬������I��Jͨ��״���³���̬��C�ʻ���ɫ��ΪCl2�������嵥��D�ڹ��������·�Ӧ�õ�I����DΪH2��IΪHCl��I��J��Ӧ�õ����H����JΪNH3��HΪNH4Cl��EΪN2������A�����嵥��B��Ӧ�õ�F�ǵ���ɫ�Ļ��������֪AΪNa��BΪO2��F��Na2O2�����������������̼��Ӧ�õ�̼������������������G����ɫ��ӦΪ��ɫ����GΪNa2CO3��
(1)N2��Na2O2�ĵ���ʽ�ֱ���![]() ��
��![]() ��
��
(2)ʵ���������Ȼ�狀���ʯ�һ�ϼ����ư�����������Ӧ�Ļ�ѧ����ʽΪ2NH4Cl + Ca(OH)2 =��=CaCl2 + 2NH3��+ 2H2O��
(3)��Na2O2��ȡO2�ķ�Ӧ�У���Ԫ�صĻ��ϼ۴�-1������Ϊ0�ۣ���ÿ������״����11.2L��O2�����ʵ���Ϊ0.5mol��ת�Ƶ��ӵ����ʵ���Ϊ0.5mol��2=1mol��
(4)Cl2��H2��N2��Ϊ���ʣ�ֻ���ڷǼ��Թ��ۼ�����HCl��NH3�����о����ڼ��Լ����Լ��Լ���ϵ���I��J ���ԷǼ��Լ���ϵ���C��D��E��
(5)HCl�ǹ��ۻ���������ʽ�γɹ���Ϊ![]() ��
��
(6)��״����1.12 L������̼�����ʵ���Ϊ![]() =0.05mol,60 mL 1 mol/L��NaOH��Һ��NaOH�����ʵ���Ϊ1 mol/L��0.06L=0.06mol���跴Ӧ����Һ��Na2CO3�����ʵ���Ϊxmol��NaHCO3�����ʵ���Ϊymol������ԭ���غ�ɵã�x+y=0.05(̼ԭ���غ�)��2x+y=0.06(��ԭ���غ�)����ã�x=0.01��y=0.04����Ӧ����Һ�����ʵ����ʵ���֮��Ϊ0.01mol��0.04mol=1:4��
=0.05mol,60 mL 1 mol/L��NaOH��Һ��NaOH�����ʵ���Ϊ1 mol/L��0.06L=0.06mol���跴Ӧ����Һ��Na2CO3�����ʵ���Ϊxmol��NaHCO3�����ʵ���Ϊymol������ԭ���غ�ɵã�x+y=0.05(̼ԭ���غ�)��2x+y=0.06(��ԭ���غ�)����ã�x=0.01��y=0.04����Ӧ����Һ�����ʵ����ʵ���֮��Ϊ0.01mol��0.04mol=1:4��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2SO2(g)+O2(g) ![]() 2SO3(g) ��H=-197kJmol-1����ͬ�¡�ͬ����������ܱ������зֱ�������壺(��) 2mol SO2��1mol O2��(��) 1mol SO2��0.5mol O2��(��) 2mol SO3�����¡������·�Ӧ��ƽ��ʱ�����й�ϵһ����ȷ����
2SO3(g) ��H=-197kJmol-1����ͬ�¡�ͬ����������ܱ������зֱ�������壺(��) 2mol SO2��1mol O2��(��) 1mol SO2��0.5mol O2��(��) 2mol SO3�����¡������·�Ӧ��ƽ��ʱ�����й�ϵһ����ȷ����
A��������ѹǿP��P��=P����2P��
B��SO3������m��m��=m����2m��
C��c(SO2)��c(O2)֮��k��k��=k����k��
D����Ӧ�ų���������������ֵQ��Q��=Q����2Q��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���谢���ӵ���������ֵΪ������������ȷ���ǣ� ��
A.��״���£�22.4L���Ȼ�̼���еķ�����ΪNA
B.1 mol������������������ĵ����Ϊ2NA
C.0.5 molL��1NaOH��Һ�� Na+��Ϊ0.5NA
D.���³�ѹ�£�16g��������������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����������һ����̼�ڴ����������³�ַ�Ӧ�����ɵ����Ͷ�����̼������õ����Ͷ�����̼�����ʵ���֮��Ϊ1��2����õ�����������( )
A��N2O B��NO
C��NO2 D��N2O5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ��Ũ���ᷴӦ�õ�����ͭ��Һ��NO2��N2O4��NO ������壬��Щ������3.36LO2���������Ϻ�ͨ��ˮ�У���������ǡ����ȫ��ˮ��������������������ͭ������Ϊ�� ��
A��6.4g B��9.6g C��19.2g D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ҫ�����
��1��д������ȲΪԭ���Ʊ�������ϩ��Ӧ����ʽ�����ﲻ�ޣ�
�� ��
�� ��
��2������ʽΪC6H12 ��ij��������̼ԭ�Ӷ���ͬһƽ���ϣ�������Ľṹ��ʽΪ_________________��������ʽΪC4H6��ij�������е�̼ԭ�Ӷ���ͬһ��ֱ���ϣ�������Ľṹ��ʽΪ___________________��
��3��1����ij��������50�����ӣ�������ֻ����һ�ֽṹ��Ȳ������õ�����������Ľṹ��ʽΪ �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�����
��1�����������������������������
������ˮ�ࡢ������Ҫ�õ���ԭ����___________(����ĸ��
A��ʯ��ʯ B������ C�����
�������˿������ά��֯��һ�ַ����䲼�ϣ����ֲ�������___________(����ĸ��
A���Ͻ���� B�����ϲ��� C���մɲ���
��SiC��һ�����͵��մ�.��ҵ����ʯӢɰ�뽹̿�ڸ�������������SiC��ͬʱ����
CO,���Ʊ���Ӧ�Ļ�ѧ����ʽΪ ��
��2����֤ʳƷ��ȫ������ʹ��ҩ�������������Ļ�����
��Ӫ��ƽ�⡢��ѧʹ��ʳƷ���Ӽ������ڽ�����������������������ʳ�����ʳƷ����������________ (����ĸ��
A���������� B��� C��������
������ҩ��ڹ��ʰ�ί���ϸ��ֹ���˷ܼ���_______(����ĸ��
A����˾ƥ�� B����ù�� C�����
������������к��еĹ�������������___________(д����)�������й���20���������ᣬ��������������������ܡ����ܡ����ϳɵİ������Ϊ�������������.
����һ֧ʢ��2 mL 2%������Һ���Թ��е���2�ε�ˮ����Һ��_____________ɫ���ٵ���ά����C��ˮ��Һ����Һ��ɫ��ȥ����ʵ��˵��ά����C����________________(��ᡱ��������������ԭ�����ԡ�
��3�����λ�����Ⱦ��������̬��������Ϊȫ��Ĺ�ʶ��
�����д�ʩ�����ڸ��ƻ�����������_______________(����ĸ��
A������̫���ܷ��磬�Ի�ȡ�����Դ
B�����ϵ�����������У��Լ�����Ⱦ
C���ϳɾ�̼������ɽ������ϴ������ϩ
����ú�м���ʯ��ʯ��Ϊ����������Լ���SO2���ŷţ�����CaSO4��д��SO2ת��ΪCaSO4�Ļ�ѧ����ʽ________________________________________��
����Ȼˮ�к��е�ϸС����������������������Ϊ���������о����������û���������ˮԭ�������ӷ���ʽ��ʾΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������ȷ���ǣ�
A. ʯ���ѽ⡢ú�ĸ��������ƴ��������ʵı��Ժ����������ӵľۼ����ǻ�ѧ�仯
B. Fe(OH)3������ɫ�������ܷ������������
C. Ư�ۡ�ˮú������ˮ�������Ϊ�����
D. Ũ��ˮ�еμ�FeCl3������Һ���Ƶ�Fe(OH)3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����t��ʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪AgCl��Ksp=4��10-10������˵������ȷ����

A����t��ʱ��AgBr��KspΪ4.9��l0-13
B����AgBr������Һ�м���NaBr���壬��ʹ��Һ��c�㵽b��
C��ͼ��a���Ӧ����AgBr�IJ�������Һ
D����t��ʱ��AgCl��s��+Br-��aq��AgBr��s��+Cl-��aq��ƽ�ⳣ��K��816
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com