
����Ŀ��
���������ķ�չ���̣�Ҳ�ǻ�ѧ���ʵ���ʶ�ͷ��ֵ����̣���������������̼����ù�ء�����ء��Ҵ������ȡ����ӡ��ı����������硣
��1����ԭ���ڻ�̬ʱ����Χ�����Ų�ʽΪ____________��
��2��CO2�ĵ���ʽΪ____________��1 mol CO2�����к��ЦҼ������ʵ���Ϊ____________��
��3��6-������ù����Ľṹ��ͼ��ʾ��
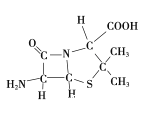
������C��N��Oԭ�Ӱ뾶�Ĵ�С��ϵΪ____________���縺�ԵĴ�С��ϵΪ____________��
�����в���sp3�ӻ���ԭ����C��____________��
��4���������NO3-�Ŀռ乹��Ϊ____________��д����NO3-��Ϊ�ȵ������һ����ǰ������Ԫ��ԭ�ӹ��ɵķǼ��Է��ӻ�ѧʽ____________��
��5���Ҵ�����Է���������������С������е��������ߣ���ԭ����____________��
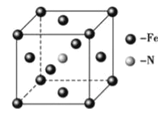
��6�����Ͱ�����640��ɷ����û���Ӧ������֮һ�ľ����ṹ��ͼ��ʾ�������������Feԭ�Ӽ�ľ���Ϊa cm����þ�����ܶȼ���ʽΪ____________g/cm3����NA��ʾ�����ӵ���������
���𰸡� 3d64s2 ![]() 2mol C>N>O C<N<O ��S��N��O ƽ�������� BF3 �Ҵ����Ӽ�������
2mol C>N>O C<N<O ��S��N��O ƽ�������� BF3 �Ҵ����Ӽ������� ![]()
![]() ��
��![]()
![]()
����������1��Fe 26��Ԫ�� ��VIII�壬��ԭ���ڻ�̬ʱ����Χ�����Ų�ʽΪ3d64s2 ����2����Ԫ�����ڱ��У�C��O��Ҫ��8�����Ӳ����ȶ�������C��O���ǹ������ӣ�ԭ��C���ֻ��4�����ӣ�����Ҫ4�����Ӳ����ȶ�����Oԭ�������6�����ӣ�������Ҫ2�����ӱ����ȶ�������C��O���γ�˫����ʹCO2�����ȶ���������̼��C=O˫����1���Ҽ���1���м�������ʽΪ![]() ��1 mol CO2�����к��ЦҼ������ʵ���Ϊ 2mol����3����ͬ����Ԫ��ԭ��ԭ������Խ��ԭ�Ӱ뾶ԼС����Ϊԭ������Խ��ԭ�Ӻ�����Խ�Ե��ӵ�����Խ��ԭ�ӵİ뾶��ԽС��C��N��Oԭ�Ӱ뾶�Ĵ�С��ϵΪC>N>O����ͬ����Ԫ�أ�ͬ���ڴ���������������������ǿ���縺�������縺�ԵĴ�С��ϵΪ C<N<O���ڶ���N����2�����һ��̼��������̼��,����һ�Թ¶Ե���,�������ԭ�Ӽ۵��Ӳ㹲��4��3+1���Ե���,����sp3�������ӻ������ǻ���O����1�����һ��̼,����2�Թ¶Ե���,�������ԭ�Ӽ۵��Ӳ㹲��4��2+2���Ե���,����sp3�������ӻ���ͬ��S��������̼,����2�Թ¶Ե���,�������ԭ�Ӽ۵��Ӳ㹲��4��2+2���Ե���,����sp3�������ӻ����ʲ���sp3�ӻ���ԭ����C��S��N��O����4��NO3����N����sp2�ӻ�������ԭ����Χ���Ե��Ӷԣ����Կռ乹��Ϊƽ�������Σ�д��һ����NO3����Ϊ�ȵ������һ�ַǼ��Է��ӵĻ�ѧʽ ����SO3����ǰ������Ԫ��ԭ�ӹ��ɵķǼ��Է��ӻ�ѧʽ������BF3����5���Ҵ���������������,ʹ���Ҵ����ǻ��ϵ������һ���Ҵ������е����γ�������Ҵ�����Է���������������С������е��������ߣ�����Ϊ�Ҵ����Ӽ������� ��һ�������к���Fe��8��18+6��12=4��Nԭ��1���������Ħ������Ϊ56��4+14=238�����������Feԭ�Ӽ�ľ���Ϊa cm�������ı߳�Ϊ
��1 mol CO2�����к��ЦҼ������ʵ���Ϊ 2mol����3����ͬ����Ԫ��ԭ��ԭ������Խ��ԭ�Ӱ뾶ԼС����Ϊԭ������Խ��ԭ�Ӻ�����Խ�Ե��ӵ�����Խ��ԭ�ӵİ뾶��ԽС��C��N��Oԭ�Ӱ뾶�Ĵ�С��ϵΪC>N>O����ͬ����Ԫ�أ�ͬ���ڴ���������������������ǿ���縺�������縺�ԵĴ�С��ϵΪ C<N<O���ڶ���N����2�����һ��̼��������̼��,����һ�Թ¶Ե���,�������ԭ�Ӽ۵��Ӳ㹲��4��3+1���Ե���,����sp3�������ӻ������ǻ���O����1�����һ��̼,����2�Թ¶Ե���,�������ԭ�Ӽ۵��Ӳ㹲��4��2+2���Ե���,����sp3�������ӻ���ͬ��S��������̼,����2�Թ¶Ե���,�������ԭ�Ӽ۵��Ӳ㹲��4��2+2���Ե���,����sp3�������ӻ����ʲ���sp3�ӻ���ԭ����C��S��N��O����4��NO3����N����sp2�ӻ�������ԭ����Χ���Ե��Ӷԣ����Կռ乹��Ϊƽ�������Σ�д��һ����NO3����Ϊ�ȵ������һ�ַǼ��Է��ӵĻ�ѧʽ ����SO3����ǰ������Ԫ��ԭ�ӹ��ɵķǼ��Է��ӻ�ѧʽ������BF3����5���Ҵ���������������,ʹ���Ҵ����ǻ��ϵ������һ���Ҵ������е����γ�������Ҵ�����Է���������������С������е��������ߣ�����Ϊ�Ҵ����Ӽ������� ��һ�������к���Fe��8��18+6��12=4��Nԭ��1���������Ħ������Ϊ56��4+14=238�����������Feԭ�Ӽ�ľ���Ϊa cm�������ı߳�Ϊ![]() ����þ�����ܶȼ���ʽΪ
����þ�����ܶȼ���ʽΪ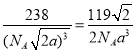 ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ָ���ȼ�ϣ�Ҳ�㷶Ӧ���ڹ�ҵ�ϳ��С�
(1)��Ħ����������ָ��25���101kPa�����ȶ��ĵ�������1 mol��������ʱ䡣��֪25���101kPaʱ���з�Ӧ��
��2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ��H=-3116kJ��mol-1
��C(ʯī,s)+O2(g)=CO2(g) ��H=-393.5 kJ��mol-1
��2H2(g)+02(g)=2H2O(l)����H=-571.6 kJ��mol-1
д������������ʵ��Ȼ�ѧ����ʽ��_____________��
(2)��֪�ϳɰ��ķ�ӦΪ��N2+3H2![]() 2NH3 ��H <0��ij�¶��£�����1molN2��2.8molH2�ֱ�Ͷ�뵽��ʼ���Ϊ2L�ĺ��º��ݡ����º�ѹ�ͺ��ݾ��ȵ������ܱ������У���÷�Ӧ������������������a��b��c��ʾ����N2��ת������ʱ��ı仯��ͼ��ʾ����ش��������⣺
2NH3 ��H <0��ij�¶��£�����1molN2��2.8molH2�ֱ�Ͷ�뵽��ʼ���Ϊ2L�ĺ��º��ݡ����º�ѹ�ͺ��ݾ��ȵ������ܱ������У���÷�Ӧ������������������a��b��c��ʾ����N2��ת������ʱ��ı仯��ͼ��ʾ����ش��������⣺

��ͼ�д�����Ӧ�ں��ݾ��������н��е�������______����a��b��c��ʾ����
������a�����¸÷�Ӧ��ƽ�ⳣ��K=__________________��
��b������M�㣬v(��)_____ v(��)������ڡ�����С�ڡ������ڡ�)��
(3)���ð���������Ƴɸ��ܻ���ȼ�ϵ�أ��øõ�ص�⺬��NO2-�ļ��Թ�ҵ��ˮ������������N2�������缫��ӦʽΪ_____����״���£��������ռ���1l.2LN2ʱ������������NH3�����Ϊ_______��
(4)��ˮ���Ʊ�ͭ����Һ�ij����Լ���ͨ�����·�Ӧ��������̽������ͭ����Һ�����;����
��֪:Cu(OH)2(s)![]() Cu2++2OH- Ksp=2.2��10-20
Cu2++2OH- Ksp=2.2��10-20
Cu2++4NH3��H2O![]() [Cu(NH3)4]2+(����ɫ)+4H2O K����7.24��1012
[Cu(NH3)4]2+(����ɫ)+4H2O K����7.24��1012
����������˵�����ø÷�Ӧ��Cu(OH)2(s)��4NH3��H2O![]() [Cu(NH3)4]2++4H2O+2OH- ����ͭ����Һ�Ƿ���У�________________��
[Cu(NH3)4]2++4H2O+2OH- ����ͭ����Һ�Ƿ���У�________________��
����֪��ӦCu(OH)2(s)��2NH3��H2O+2NH4+![]() [Cu(NH3)4]2++4H2O K=5.16��102����ʢ������Cu(OH)2������Թ��м���14 mol/L�İ�ˮ���õ�����Һ����ʱ����������������粒��壬���ֵ�����Ϊ__________�����ͳ��ָ������ԭ����_____________________��
[Cu(NH3)4]2++4H2O K=5.16��102����ʢ������Cu(OH)2������Թ��м���14 mol/L�İ�ˮ���õ�����Һ����ʱ����������������粒��壬���ֵ�����Ϊ__________�����ͳ��ָ������ԭ����_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣�X��Y��Z��W��Ϊ������Ԫ�أ�ZԪ��ԭ���������������������֮��Ϊ1��3��������˵����ȷ����

A. ԭ�Ӱ뾶��СΪW>Z>Y>X
B. W����ۺ������������ǿ
C. X��Z��Y��W�����{���۷ֱ�Ϊ+4��+5��+6��+7
D. Z��W�γɵ����л�������.ԭ���������Ӿ��ﵽ8e-�ȶ��ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ��Ը�������Ҫ�ɷ�Ϊ�Ǹ�������FeCr2O4��������Al2O3��SiO2�����ʣ�Ϊ��Ҫԭ�������췯�ƣ�Na2Cr2O7����ijʵ��С��ģ������������ͼ��ʾ��
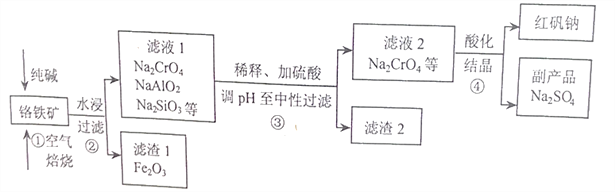
��1��FeCr2O4��Cr�Ļ��ϼ�Ϊ____________������ٱ���ʱ���õ���������Ϊ_________�������������Na2CrO4�Ļ�ѧ����ʽΪ________________________��
��2����������շ�Ӧ��������Ҫ���������������״̬����Ӧ���ʲżӿ죬����Ҫԭ��Ϊ________��
��3������ڹ���ʱ���õ��IJ���������________________��
��4������������Ὣ��Һ��pH�������ԣ���������2����Ҫ�ɷ���__________��__________��
��5�����������Һ2���������ữ�����У���Һ�ɻ�ɫ��Ϊ��ɫ����Ӧ�����ӷ���ʽΪ___________��
��6����ͼ��Na2Cr2O7��2H2O��Na2SO4���ܽ�����ߣ�������л�ø���ƷNa2SO4��ʵ���������Ϊ____________________��
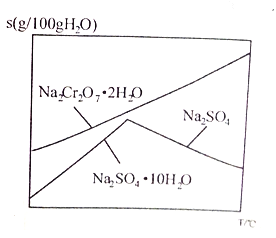
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���谢���ӵ���������ֵΪ������������ȷ���ǣ� ��
A.��״���£�22.4L���Ȼ�̼���еķ�����ΪNA
B.1 mol������������������ĵ����Ϊ2NA
C.0.5 molL��1NaOH��Һ�� Na+��Ϊ0.5NA
D.���³�ѹ�£�16g��������������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����м���ڹ�����������ټ����������ʣ��������������ɵ��ǣ� ��
A.ϡ����
B.����
C.����п
D.�Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����������һ����̼�ڴ����������³�ַ�Ӧ�����ɵ����Ͷ�����̼������õ����Ͷ�����̼�����ʵ���֮��Ϊ1��2����õ�����������( )
A��N2O B��NO
C��NO2 D��N2O5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ҫ�����
��1��д������ȲΪԭ���Ʊ�������ϩ��Ӧ����ʽ�����ﲻ�ޣ�
�� ��
�� ��
��2������ʽΪC6H12 ��ij��������̼ԭ�Ӷ���ͬһƽ���ϣ�������Ľṹ��ʽΪ_________________��������ʽΪC4H6��ij�������е�̼ԭ�Ӷ���ͬһ��ֱ���ϣ�������Ľṹ��ʽΪ___________________��
��3��1����ij��������50�����ӣ�������ֻ����һ�ֽṹ��Ȳ������õ�����������Ľṹ��ʽΪ �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��װ�ý��е��ʵ�顣A����ͭ���Ͻ�B��Ϊ��ͭ���������ҺΪ����ͭ��Һ(����)��ͨ��һ��ʱ���A��ǡ��ȫ���ܽ⣬��ʱB����������3.2g����Һ��������0.05 g������֪�����ԣ�Cu2+>Ni2+����A�Ͻ���ͭ����ԭ�Ӹ�����Ϊ

A��4��1 B��3��1 C��2��1 D��1��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com