
【题目】氢气是一种高能燃料,也广范应用在工业合成中。
(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1 mol化合物的焓变。已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=-3116kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
③2H2(g)+02(g)=2H2O(l),△H=-571.6 kJ·mol-1
写出乙烷标准生成焓的热化学方程式:_____________。
(2)已知合成氨的反应为:N2+3H2![]() 2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:

①图中代表反应在恒容绝热容器中进行的曲线是______(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=__________________。
③b容器中M点,v(正)_____ v(逆)(填“大于”、“小于”.或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为_____;标准状况下,当阴极收集到1l.2LN2时,理论上消耗NH3的体积为_______。
(4)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径。
已知:Cu(OH)2(s)![]() Cu2++2OH- Ksp=2.2×10-20
Cu2++2OH- Ksp=2.2×10-20
Cu2++4NH3·H2O![]() [Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
①请用数据说明利用该反应:Cu(OH)2(s)+4NH3·H2O![]() [Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
[Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
②已知反应Cu(OH)2(s)+2NH3·H2O+2NH4+![]() [Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
[Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
【答案】 2C(石墨)+ 3H2(g)=C2H6(g) △H=-86.4kJ/mol c 800 小于 2NO2-+6e-+4H2O= N2+ 8OH- 22.4L 该反应的K=Ksp·Kβ=1.6×10-7<10-5所以反应很难进行 固体溶解,得到深蓝色溶液 溶液中存在平衡Cu(OH)2(s)+2NH3·H2O+2NH4+![]() [Cu(NH3)4]2++4H2O, 加入硫酸铵固体增大了铵根离子浓度,平衡正向移动
[Cu(NH3)4]2++4H2O, 加入硫酸铵固体增大了铵根离子浓度,平衡正向移动
【解析】本题考查盖斯定律的应用,②×2+③×3/2-①/2得出:2C(石墨)+ 3H2(g)=C2H6(g) △H=-86.4kJ/mol;(2)①恒容绝热容器,正反应是放热反应,随着反应进行,温度升高,化学反应速率升高,先达到平衡,符合条件的曲线是c;② 此反应是气体物质的量减少的,恒温恒容是的反应速率小于恒温恒压,即b为恒温恒容时的曲线,a为恒温恒压时的曲线,化学平衡常数只受温度的影响,温度不变,化学平衡常数不变,即N2+3H2![]() 2NH3
2NH3
起始(mol·L-1) 0.5 1.4 0
变化: 0.4 1.2 0.8
平衡: 0.1 0.2 0.8 根据化学平衡常数的定义,K=c2(NH3)/(NH3)/[c3(H2)×c(N2)]=800;③M点达到b曲线上,N2的转化率降低,说明反应向逆反应方向移动,即v(正)<v(逆);(3)根据电解的原理,阴极上得到电子,化合价降低,根据信息NO2-→N2,化合价由+3价→0价,NO2-在阴极上放电,因此阴极反应式为:2NO2-+4H2O+6e-=N2+8OH-,阳极上失去电子化合价升高,阴极上收集到11.2L的N2,消耗NO2-的物质的量11.2×2/22.4mol=1mol,NH3在阳极上失电子,根据得失电子守恒,n(NH3)×3=n(NO2-)×3,解得n(NH3)=1mol,合22.4L;(4)①根据平衡常数定义,K=c2(OH-)×c(Cu[NH3]4]2-)/c4(NH3·H2O)= c2(OH-)×c(Cu[NH3]4]2-)×c(Cu2+)/[c4(NH3·H2O) ×c(Cu2+)]=Ksp×Kβ=2.2×10-20×7.24×1012=1.6×10-7<10-5,此反应很难进行;②溶液中存在平衡Cu(OH)2(s)+2NH3·H2O+2NH4+![]() [Cu(NH3)4]2++4H2O, 加入硫酸铵固体增大了铵根离子浓度,平衡正向移动,现象是固体溶解,得到深蓝色溶液。
[Cu(NH3)4]2++4H2O, 加入硫酸铵固体增大了铵根离子浓度,平衡正向移动,现象是固体溶解,得到深蓝色溶液。


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法不正确的是
A. 乙烯可作水果的催熟剂
B. 硅胶可作袋装食品的干燥剂,铁粉可做脱氧剂
C. 福尔马林可作食品的保鲜剂
D. 氢氧化铝可作胃酸的中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,请按要求回答下列问题:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | A | |||||||
二 | D | E | G | I | ||||
三 | B | C | F | H |
(1)A-I中元素,化学性质最不活泼的是______(用元素符号),还原性最强的单质是______(用元素符号);
(2)A-I中最高价氧化物的水化物酸性最强的酸是______(用化学式);
(3)用电子式表示D元素最高价氧化物的形成过程_______________________________ ;
D元素最高价氧化物的结构式为______
(4)写出B与C两元素最高价氧化物的水化物之间反应的离子方程式___________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2 L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
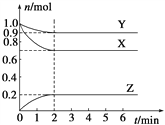
(1)该反应的化学方程式为_______________。
(2)反应开始至2 min,气体Z的反应速率为____________。
(3)若X、Y、Z均为气体,反应达到平衡时,压强是开始时的________倍;此时放出了a kJ的热量,则按(1)的反应方程式写成热化学反应方程式时,该反应的反应热ΔH=_____________。
(4)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。已知:
化学键 | H—H | H—Cl | Cl—Cl |
键能/ kJ·mol–1 | 436 | 431 | 242 |
工业上通过氢气在氯气中充分燃烧制取HCl气体,写出该反应的热化学反应方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O (l) △H=-57.3 KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是( )
A.△H1>△H2>△H3 B.△H1<△H2<△H3
C.△H1>△H2=△H3 D.△H1=△H2<△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)根据如图所示情况,判断下列说法中正确的是 。
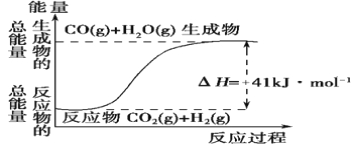
A.其热化学方程式为:CO(g)+ H2O(g)=CO2(g) + H2(g) ΔH=+41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是 。
(3)已知反应:N2(g) + O2 (g)=2NO(g) △H1
2H2(g)+ O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H4 的反应焓变为 (用含△H1、△H2、△H3的式子表示)。
(4)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:已知反应2HI(g) ![]() H2(g)+I2(g) 的△H=+11kJmol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
H2(g)+I2(g) 的△H=+11kJmol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是( )
A.除去N2 中少量的O2:通过灼热的CuO 粉末,收集气体
B.除去CO2 中的少量HCl:通入NaOH 溶液,收集气体
C.除去CaCl2 溶液中混有少量的盐酸,可加入过量的CaCO3 , 充分反应后过滤
D.除去KCl 溶液中的少量MgCl2:加入适量NaOH 溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、二氧化碳、青霉素、硝酸钾、乙醇、氨等“分子”改变过人类的世界。
(1)铁原子在基态时,外围电子排布式为____________。
(2)CO2的电子式为____________,1 mol CO2分子中含有σ键的物质的量为____________。
(3)6-氨基青霉烷酸的结构如图所示:
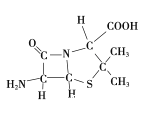
①其中C、N、O原子半径的大小关系为____________,电负性的大小关系为____________;
②其中采用sp3杂化的原子有C、____________。
(4)硝酸钾中NO3-的空间构型为____________,写出与NO3-互为等电子体的一种由前二周期元素原子构成的非极性分子化学式____________。
(5)乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是____________。
(6)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,若两个最近的Fe原子间的距离为a cm,则该晶体的密度计算式为____________g/cm3(用NA表示阿伏加德罗常数)。
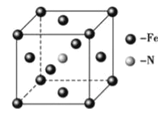
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com