
| A. | 3-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 3,3,4,4-四甲基庚烷 | D. | 3,5-二甲基乙烷 |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长-----选最长碳链为主链;
②多-----遇等长碳链时,支链最多为主链;
③近-----离支链最近一端编号;
④小-----支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面.
解答 解:A.支链编号之和必须最小,正确命名是:3,4-二甲基己烷,故A错误;
B.不符合烷烃命名原则,主链不是最长,主链编号之和不最小等,应该是3,3,4-三甲基己烷,故B错误;
C.符合烷烃命名原则,主链最长,主链编号之和最小等,故C正确;
D.主链不是最长,故D错误.
故选C.
点评 本题考查烷烃的命名,难度不大,烷烃命名要抓住五个“最”:①最长-----选最长碳链为主链;②最多-----遇等长碳链时,支链最多为主链;③最近-----离支链最近一端编号;④最小-----支链编号之和最小(两端等距又同基,支链编号之和最小);⑤最简-----两不同取代基距离主链两端等距离时,从简单取代基开始编号.


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| B. | 最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物 | |
| C. | 绿色化学反应选择的原料、催化剂、溶剂都应该是无毒无害的 | |
| D. | 乙烯分别与溴水和溴的四氯化碳溶液反应制备1,2-二溴乙烷的原子利用率均为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )
伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )| A. | 伏打电堆能将电能转化成化学能 | B. | 锌是正极 | ||
| C. | 盐水是电解质溶液 | D. | 伏打电堆工作时铜被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
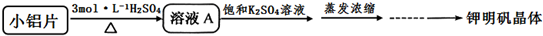
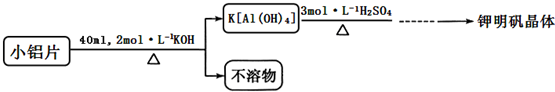
| 温度(℃) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| K2SO4 | 7.4 | 9.2 | 11.1 | 12.97 | 14.8 | 16.6 | 18.17 | 19.8 | 21.4 | 22.4 | 24.1 |
| Al2(SO4)3•18H2O | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 | 59.2 | 66.2 | 73.1 | 86.8 | 89.0 |
| KAl(SO4)2•12H2O | 3.0 | 4.0 | 5.9 | 8.4 | 11.7 | 17.0 | 24.8 | 40.0 | 71.0 | 109.0 | 154.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
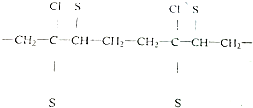
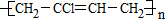 _.
_.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化合物中只存在极性键 | |
| B. | 碳原子最外层有4个电子,在形成化合物时必须与4个原子结合 | |
| C. | 碳原子间可形成非极性键 | |
| D. | 碳原子易失去或获得电子而形成阳离子或阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知K=$\frac{{c}^{2}C{O}_{2}•{c}^{6}•{H}_{2}}{{c}^{3}{H}_{2}O•cC{H}_{3}C{H}_{2}OH}$,则对应的化学反应可以表示为2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g) | |
| B. | 将某浓度氢氟酸溶液升高温度,氢氟酸的电离度(α)和电离平衡常数Ka都变大 | |
| C. | 常温下,向纯水中加入碳酸钠,水的电离程度变大,KW变大 | |
| D. | 化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
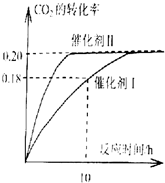 已知CO2可以生产绿色燃料甲醇,反应如下:
已知CO2可以生产绿色燃料甲醇,反应如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com