
【题目】Fe、Cu、Cr都是第四周期过渡元素,回答下列问题。
(1)FeCl3是一种常用的净水剂,Cl元素的原子核外有___种不同运动状态的电子;有___种不同能级的电子,基态Fe3+的电子排布式为___。
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是___;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的![]() 结构如图所示(K+未画出),则一个晶胞中的K+个数为___。
结构如图所示(K+未画出),则一个晶胞中的K+个数为___。

(3)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:![]() ,该配离子中含有的化学键类型有___(填字母)。
,该配离子中含有的化学键类型有___(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
一个乙二胺分子中共有___个σ键,C原子的杂化方式为___。
(4)金属铜的晶胞为面心立方最密堆积,边长为361pm。则铜原子的直径约为___pm。
【答案】17 5 1s22s22p63s23p63d5 K2[Fe(SCN)5] 4 abd 11 sp3 ![]()
【解析】
⑴每个电子的运动状态均不同,氯原子核外电子分布在1s、2s、2p、3s、3p这五个能级;铁原子失去4s能级2个电子,再失去3d能级1个电子形成Fe3+。
⑵Fe3+与SCN-形成配位数为5的配离子为[Fe(SCN)5]2-,根据电荷守恒可知配离子与K+形成的配合物的化学式为K2[Fe(SCN)5];计算晶胞中其他微粒的个数,再根据电荷守恒计算钾离子的个数。
⑶根据配合物的结构可以知道含有的化合建,并计算σ数,求出杂化方式。
⑷面心立方最密堆积的晶胞结构中,处于面对角线上的Cu原子紧密相邻,面对角线的长度为铜原子直径的2倍。
⑴氯原子核外电子数为17,每个电子的运动状态均不同,故氯原子核外有17种不同运动状态的电子;氯原子核外电子排布式为1s22s22p63s23p5,电子分布在1s、2s、2p、3s、3p这五个能级;Fe是26号元素,铁原子核外电子排布式为1s22s22p63s23p63d64s2,铁原子失去4s能级2个电子,再失去3d能级1个电子形成Fe3+,故基态Fe3+的电子排布式为1s22s22p63s23p63d5;故答案为:17;5;1s22s22p63s23p63d5。
⑵Fe3+与SCN-形成配位数为5的配离子为[Fe(SCN)5]2-,根据电荷守恒可知配离子与K+形成的配合物的化学式为K2[Fe(SCN)5];题给物质晶胞的![]() 结构中,Fe3+的个数为4×
结构中,Fe3+的个数为4×![]() =
=![]() ,Fe2+的个数为4×
,Fe2+的个数为4×![]() =
=![]() ,CN-的个数为12×
,CN-的个数为12×![]() =3,根据电荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2 = N(CN-),可得N(K+)=
=3,根据电荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2 = N(CN-),可得N(K+)=![]() ,故一个晶胞中的K+个数为
,故一个晶胞中的K+个数为![]() ×8=4,故答案为:K2[Fe(SCN)5];4。
×8=4,故答案为:K2[Fe(SCN)5];4。
⑶Cu2+与乙二胺(H2N—CH2—CH2—NH2)之间形成配位键,H2N—CH2—CH2—NH2中碳原子之间形成非极性键,不同原子之间形成极性键;单键为σ键,一个乙二胺分子中含有11个σ键,碳原子没有孤电子对,且形成4个σ键,杂化轨道数目为4,碳原子采取sp3杂化,故答案为:abd;11;sp3。
⑷面心立方最密堆积的晶胞结构中,处于面对角线上的Cu原子紧密相邻,面对角线的长度为铜原子直径的2倍,由几何知识可知面对角线长度等于晶胞边长的![]() 倍,故铜原子的直径约为=
倍,故铜原子的直径约为=![]() =
=![]() pm,故答案为
pm,故答案为![]() pm。
pm。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如图:
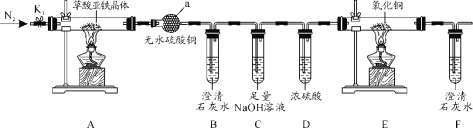
(1)仪器a的名称是___。
(2)从绿色化学考虑,该套装置存在的明显缺陷是___。
(3)向盛有草酸亚铁晶体的试管中滴入硫酸酸化的KMnO4溶液,振荡,溶液变为棕黄色,同时有气体生成。已知反应中MnO![]() 转化为无色的Mn2+,则该过程中被氧化的元素是___。若反应中消耗lmolFeC2O4·2H2O,则参加反应的n(KMnO4)=___。
转化为无色的Mn2+,则该过程中被氧化的元素是___。若反应中消耗lmolFeC2O4·2H2O,则参加反应的n(KMnO4)=___。
(4)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验试剂是___。
(5)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如图所示:
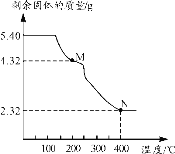
①图中M点对应物质的化学式为___。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出该化合物与稀盐酸反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B的结构简式如下:

(1)A分子中含有的官能团的名称是____________________________________。
(2)A、B能否与NaOH溶液反应:A________(填“能”或“不能”,下同),B________。
(3)A在浓硫酸作用下加热可得到B,其反应类型是____________________。
(4)A、B各1 mol分别加入足量溴水,完全反应后消耗单质溴的物质的量分别是________mol、________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知PbI2的Ksp=7.0×10-9,将7.5×10-3 mol/L的KI与一定浓度的Pb(NO3)2溶液按2∶1体积混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为
A.8.4×10-4mol/LB.5.6×10-4mol/L
C.4.2×10-4mol/LD.2.8×10-4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纪录片《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也让人体会到化学方法在文物保护中的巨大作用。
Ⅰ.某博物馆修复出土铁器的过程如下:
(1)检测锈蚀物的成分。
锈蚀物主要成分的化学式 | |||
Fe3O4 | Fe2O3·H2O | FeO(OH) | FeOCl |
FeOCl中铁元素的化合价为_______。
(2)化学修复方法:脱氯、还原,形成Fe3O4保护层。(已知:Cl-会加快铁的腐蚀)
修复过程:将铁器浸没在盛有0.5 mol·L-1 Na2SO3、0.5 mol·L-1 NaOH溶液的容器中,缓慢加热至60~90℃,一段时间后取出器物,用NaOH溶液洗涤至无Cl-。
①脱氯反应:FeOCl + OH- = FeO(OH) + Cl-。离子反应是向着离子浓度减小的方向进行的,则相同温度下,FeOCl与FeO(OH)的溶解度:s(FeOCl)______s[FeO(OH)](填>、<或=)。
②还原反应:Na2SO3还原FeO(OH)形成Fe3O4。配平化学方程式:
___Na2SO3 + ___FeO(OH) = ___Na2SO4 + ___Fe3O4 + ___H2O
③检验Cl-是否洗涤干净的方法是_______________。
Ⅱ.若要配制500mL 0.5mol·L-1的NaOH溶液用于洗涤器物,回答下列问题:
(3)配制时,应用天平称取NaOH的质量为___________(精确到小数点后两位)。
(4)某操作步骤如图所示:
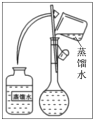
该操作应放在如图所示的____________(填序号)操作之间。
① ②
②![]() ③
③![]() ④
④![]() ⑤
⑤ ⑥
⑥![]()
(5)下列说法错误的是_____________(填标号)。
A.称量NaOH固体的时间不宜过长
B.待烧杯中溶液冷却至室温才进行转移
C.定容时,仰视容量瓶刻度线会使配制的NaOH溶液浓度偏高
D.容量瓶可存放配好的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下,![]() 的溶液一定是酸溶液
的溶液一定是酸溶液
B.常温下,![]() 的醋酸溶液和
的醋酸溶液和![]() 的氢氧化钠溶液等体积混合后,溶液呈碱性
的氢氧化钠溶液等体积混合后,溶液呈碱性
C.在相同温度下,物质的量浓度相等的氢氧化钠、氨水溶液,![]()
D.向醋酸钠溶液中滴加醋酸至![]() ,则溶液呈中性
,则溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() (酸式盐)溶液分别滴加
(酸式盐)溶液分别滴加![]() 盐酸或
盐酸或![]() 溶液,溶液的pH与滴加溶液体积关系如图所示。下列推断正确的是( )
溶液,溶液的pH与滴加溶液体积关系如图所示。下列推断正确的是( )

A.NaHA在水中电离程度大于水解程度
B.在对应的各点溶液中H点水电离程度最大
C.E点对应的溶液中,![]()
D.F点对应的溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示。

(1)若A为强碱,C、D常被用做食用“碱”。C → D反应的离子方程式为 ______________。
(2)若A为使用最广泛的金属单质,B是某强酸的稀溶液,则检验D溶液中金属阳离子的试剂为_____________,D → C反应的离子方程式为___________。
(3)若A为非金属单质,D是空气中的主要温室气体。D还可以转化为A,写出该反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g),反应过程中的能量变化情况如图所示。
CH3OH(g),反应过程中的能量变化情况如图所示。
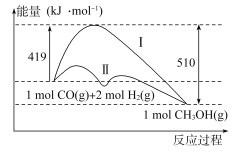
(1)曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。该反应是________(填“吸热”或“放热”)反应。计算当反应生成1.5 mol CH3OH(g)时,能量变化是________kJ。
(2)选择适宜的催化剂________(填“能”或“不能”)改变该反应的反应热。
(3)推测反应CH3OH(g)![]() CO(g)+2H2(g)是________(填“吸热”或“放热”)反应。
CO(g)+2H2(g)是________(填“吸热”或“放热”)反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com