
【题目】常温下,向![]() (酸式盐)溶液分别滴加
(酸式盐)溶液分别滴加![]() 盐酸或
盐酸或![]() 溶液,溶液的pH与滴加溶液体积关系如图所示。下列推断正确的是( )
溶液,溶液的pH与滴加溶液体积关系如图所示。下列推断正确的是( )

A.NaHA在水中电离程度大于水解程度
B.在对应的各点溶液中H点水电离程度最大
C.E点对应的溶液中,![]()
D.F点对应的溶液中![]()
 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.常温下,0.1mol·L-1 氨水的 pH=11: NH3·H2O NH4+ + OH-
B.Mg 和 Cl 形成离子键的过程: 
C.电解 CuCl2 溶液: CuCl2 == Cu2+ + 2Cl-
D.乙酸与乙醇发生酯化反应: CH3COOH + C2H518OH![]() CH3COOC2H5 + H218O
CH3COOC2H5 + H218O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
碱金属及碳族元素在科研领域、生活和生产方面有广泛的应用。回答下列问题:
(1)在元素周期表中,与Li的化学性质最相似的邻族元素是__________(填元素符号),该元素基态原子最外层电子的自旋状态___________(填“相同”或“相反”)。
(2)碳和硅的有关化学键键能如下所示:
化学键 | C-H | C-O | Si-H | Si-O |
键能/kJmol-1 | 413 | 336 | 318 | 452 |
SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________。
(3)天然硅酸盐都是由[SiO4]四面体以顶角氧原子相连而成,可成链状也可成环,所以硅酸盐种类繁多。下图a代表SiO44-,b、c是硅氧四面体形成的环状结构。
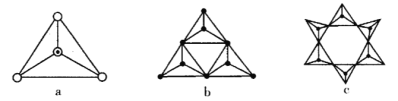
硅氧四面体中Si的轨道杂化类型为____________; 图b环状结构硅酸根的化学式为______________若在环状结构中硅的原子数为n,写出环状结构中硅酸根的通式_____________。
(4)钾与溴作用能形成溴化钾晶体,该晶体类型为___________,其晶格能可通过下图的Borm-Haber循环计算得到。

从上图可知,K原子的第一电离能为_____ kJ/mol, Br-Br键键能为______kJ/ mol,KBr的晶格能为______kJ/mol,晶格能越大,该晶体的熔点越______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Cu、Cr都是第四周期过渡元素,回答下列问题。
(1)FeCl3是一种常用的净水剂,Cl元素的原子核外有___种不同运动状态的电子;有___种不同能级的电子,基态Fe3+的电子排布式为___。
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是___;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的![]() 结构如图所示(K+未画出),则一个晶胞中的K+个数为___。
结构如图所示(K+未画出),则一个晶胞中的K+个数为___。

(3)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:![]() ,该配离子中含有的化学键类型有___(填字母)。
,该配离子中含有的化学键类型有___(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
一个乙二胺分子中共有___个σ键,C原子的杂化方式为___。
(4)金属铜的晶胞为面心立方最密堆积,边长为361pm。则铜原子的直径约为___pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置进行乙醇氧化反应的探究实验,以下叙述错误的是( )
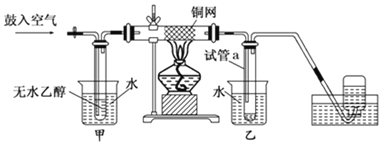
A.铜网表面乙醇发生氧化反应
B.甲、乙烧杯中的水均起冷却作用
C.试管a收集到的液体中至少有两种有机物
D.实验开始后熄灭酒精灯,铜网仍能红热,说明发生的是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
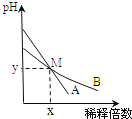
A.稀释前,![]()
B.稀释前,A溶液中由水电离出的![]() 的浓度大于
的浓度大于![]()
C.用醋酸中和A溶液至恰好完全反应时,溶液的pH为7
D.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列叙述错误的是
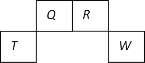
A.元素的非金属性:Q 强于 W
B.T 的氧化物能与 NaOH 溶液反应
C.R 元素的气态氢化物能与其最高价氧化物对应的水化物反应
D.Q 和 W 元素形成化合物 QW2分子中,各原子的最外层均满足 8 电子的稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C(s)+2H2(g)![]() CH4(g) ΔH。在1 L密闭容器中投入1mol碳,并充入2mol H2,测得相关数据如图所示。
CH4(g) ΔH。在1 L密闭容器中投入1mol碳,并充入2mol H2,测得相关数据如图所示。

(已知:可用平衡分压代替平衡浓度算出平衡常数Kp,分压=总压×物质的量分数 )下列有关说法错误的
A.ΔH<0B.p1<6MPaC.T1<1 000 KD.A点的平衡常数Kp=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com