
【题目】C(s)+2H2(g)![]() CH4(g) ΔH。在1 L密闭容器中投入1mol碳,并充入2mol H2,测得相关数据如图所示。
CH4(g) ΔH。在1 L密闭容器中投入1mol碳,并充入2mol H2,测得相关数据如图所示。

(已知:可用平衡分压代替平衡浓度算出平衡常数Kp,分压=总压×物质的量分数 )下列有关说法错误的
A.ΔH<0B.p1<6MPaC.T1<1 000 KD.A点的平衡常数Kp=![]()
【答案】D
【解析】
A.有图像1,在等压线下,升高温度,碳的平衡转化率降低,说明平衡逆向进行,逆反应是吸热反应,正反应是放热反应,ΔH<0,故A正确;
B.有图像1,向横坐标作垂线,即等温线,该反应正向是体积缩小的反应,碳的转化率越高 ,说明平衡正向进行,压强越大,即p1<6Mpa,故B正确;
C. 有选项A可知,正反应是放热反应,向横坐标作垂线,即是等压线,保持压强不变,升高温度,平衡逆向进行,碳的转化率降低,故T1<1 000 K,故C正确;
D.起始C和H2的物质的量分别为1mol和2mol,在A点碳的平衡转化率为50%,
可逆反应C(s)+2H2(g)CH4(g)
开始(mol)1 2 0
反应(mol)0.5 10.5
平衡(mol)0.5 10.5
平衡时P(H2)=1mol÷(0.5mol+1mol+0.5mol)×4.5MPa、P(CH4)=0.5mol÷(0.5mol+1mol+0.5mol)×4.5MPa,该反应的平衡常数Kp= P(CH4)÷P2(H2)= (0.5mol÷(0.5mol+1mol+0.5mol)×4.5MPa)÷(1mol÷(0.5mol+1mol+0.5mol)×4.5Mpa)2=2/9,故D错误;
故选:D.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】(1)一种铜金合金晶体具有面心立方体结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为________。
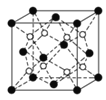
(2)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(如下图)的结构相似,该晶体储氢后的化学式应为________。
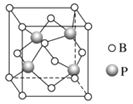
(3)立方BP(磷化硼)的晶胞结构如下图所示,晶胞中含B原子数目为________。
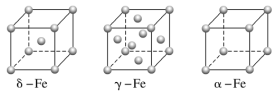
(4)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为________,δ、α两种晶胞中铁原子的配位数之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关反应2SO2+O2![]() 2SO3的说法中不正确的是
2SO3的说法中不正确的是
A.实际生产中,SO2、O2再循环使用体现绿色化学
B.实际生产中,为了提高经济效率压强越高越好
C.在生产中,通入过量空气的目的是提高SO2的转化率
D.实际生产中,选定400℃~500℃作为操作温度的主要原因是催化剂的活性最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列问题:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置______,基态E2+价电子的排布图为_______,B元素能量最高的电子其轨道呈_______形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为___________。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为_____________,B、C、D简单离子的半径由大到小的顺序为_________。
(4)写出C的核外有18个电子的氢化物的电子式________。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO = E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___________。
(6)已知沸点:B2H4>A2H6 ,主要原因为____________________。
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为a cm,该晶体的密度为________ g·cm-3(用含a和NA的式子表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷(C8H8)其八个碳原子对称地排列在立方体的八个角上。以下相关说法错误的是

A. 立方烷在空气中可燃,燃烧有黑烟产生
B. 立方烷一氯代物1种、二氯代物有3种
C. 立方烷是苯(C6H6)的同系物,也是苯乙烯(C6H5-CH=CH2)的同分异构体
D. 八硝基立方烷完全分解可能只产生二氧化碳和氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
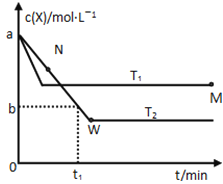
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C.M点的正反应速率υ正大于N点的逆反应速率υ逆
D.M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇制取乙烯,用电石(主要成分为CaC2,含少量CaS)制取乙炔。
(1)实验室制取乙烯的化学方程式为_____________________________,可用于制取乙烯的发生装置是_______。(选填编号)

a b c d
(2)制备乙烯气体时,常因温度过高而观察到溶液变黑,同时能闻到有刺激性气味的气体生成。在乙烯气体的制备过程中,浓硫酸没有体现的性质是________。
a 吸水性 b 脱水性 c 强氧化性 d 酸性
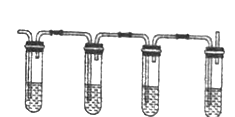
① ② ③ ④
有同学设计下列实验确认上述混合气体中有乙烯和二氧化硫。
上图中①、②、③、④装置盛放的试剂分别是(根据需要进行选择,填标号):
①_______________,②_______________,③_______________,④______________。
A 品红溶液 B NaOH溶液 C 浓硫酸 D 酸性高锰酸钾溶液
(3)实验室制备乙炔的化学反应方程式为_________________________________。实验室制乙炔时为避免电石和水反应过于激烈,除用分液漏斗控制滴速外,通常还可用_________代替水。为除去乙炔中混有的少量硫化氢杂质,可将气体通过___________(选填编号)。
a酸性KMnO4溶液 b CCl4 c NaOH溶液 d CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的H2SO4溶液中,分别滴入物质的量浓度相等的Ba(OH)2、NaOH溶液,其导电能力随滴入溶液体积变化的曲线如下图所示,下列分析不正确的是

A. ①代表滴加Ba(OH)2溶液的变化曲线 B. a、c两点,溶液中均大量存在H+和SO42-
C. b、d两点对应的溶液均显中性 D. e点,两溶液中含有相同量的OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应L(s)+aG(g)=bR(g)达到平衡时温度和压强对该反应的影响如下图所示,x轴表示温度,y轴表示平衡混合气中G的体积分数,压强P1>P2,下列判断正确的是
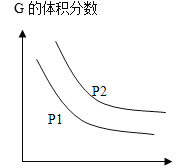
A.a>b
B.△H<0
C.当av正(G)=bv逆(R)可说明反应达到平衡状态
D.增加L的物质的量,可提高G的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com