
����Ŀ���������������������������Ҫԭ��֮һ���������������ж��ַ�����
(1)Ŀǰ��Ӧ����㷺���������������ѳ�������NH3����ԭ������ѧ��Ӧ�ɱ�ʾΪ��
2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) ��H��0
�ٸ÷�Ӧ�У���Ӧ��������_____(�>������<����=��)��������������
�ڵ��÷�Ӧ��2mol N2(g)����ʱ��ת�Ƶ��ӵ����ʵ���Ϊ__mol��
�۸÷�Ӧ�У���ԭ��Ϊ______(�ѧʽ�������������뻹ԭ�����������Ϊ______________��
(2)Ҳ�������ü������ԭ���������֪��
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H=-574kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H=-867kJ/mol
��CH4(g)��NO(g)��ԭΪN2(g)���Ȼ�ѧ����ʽ��_________________��
(3)��������ClO2���������������Ⱦ����Ӧ��������(���ַ�Ӧ�����������ȥ)��![]()
��ӦI�IJ����л�������ǿ�����ɣ�������һ��ǿ��Ϊ���ᣬ��������NO3���ʵ�����ȣ�����ѧ��Ӧ����ʽΪ______����Ӧ��������22.4L N2(��״��)��������ClO2______g��
(4)����ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ���

������ȼ�ϵ�ص�����ת����Ҫ��ʽ��________������ʱ��������Ϊ________����a��b�ͼ�ͷ��ʾ����
�ڸ����ĵ缫��ӦʽΪ__________________��
�۵缫����Ʋ��۵�ԭ��Ϊ____________________��
���𰸡� �� 6 NH3 1 :1 CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H=��1160kJ��mol��1 2NO + ClO2 + H2O = NO2 + HNO3 + HCl 135 ��ѧ�������� b��a H2��2e��+2OH��=2H2O ����缫��λ�������H2��O2�ķ�����������Ӧ����
�����������������������Ҫ���鷴Ӧ�ȵļ��㼰ԭ��ط�Ӧԭ����
(1) ���÷�Ӧ�Ƿ��ȷ�Ӧ����Ӧ��������>��������������
�����÷�Ӧ��2mol N2(g)����ʱ��N2��3e-��ת�Ƶ��ӵ����ʵ���Ϊ6mol��
���÷�Ӧ�У���ԭ��ΪNH3�����������뻹ԭ�����������Ϊ1:1��
(2)����֪�������Ȼ�ѧ����ʽ������עΪ�٢ڣ�2��-�ٵ�CH4(g)��NO(g)��ԭΪN2(g)���Ȼ�ѧ����ʽ��CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H=��1160kJ��mol��1 ��
(3)���������غ㶨�ɿ����ж���һ��ǿ����HCl����ѧ��Ӧ����ʽΪ2NO + ClO2 + H2O = NO2 + HNO3 + HCl����Ӧ��������22.4L��1mol N2(��״��)��2ClO2��2NO2��N2��������ClO22mol��135 g��
(4) ������ȼ�ϵ�ص�����ת����Ҫ��ʽ�ǻ�ѧ�������ܣ�O2���ڵĵ缫������������ʱ��������Ϊb��a ��
��H 2���ڵĵ缫�Ǹ����������ĵ缫��ӦʽΪH2��2e��+2OH��=2H2O��
���缫����Ʋ��۵�ԭ��Ϊ����缫��λ�������H2��O2�ķ�����������Ӧ������


 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ����Cl2��2KBr=2KCl��Br2��
��KClO3��6HCl=3Cl2����KCl��3H2O��
��2KBrO3��Cl2=Br2��2KClO3������˵����ȷ����
A. ����������Ӧ���е������ɣ����Զ����û���Ӧ
B. ��������ǿ����˳��ΪKBrO3>KClO3>Cl2>Br2
C. ��Ӧ���л�ԭ���������������ʵ���֮��Ϊ6��1
D. ����1 mol��ԭ����Ӧ���������õ����ӵ����ʵ���Ϊ2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��������ͼװ�����ⶨijԭ��ع���ʱ��ij��ʱ����ͨ�����ߵĵ��ӵ����ʵ�������Ͳ�Ĺ��Ϊ1000 mL����ѡ��ĵ缫�����д�ͭƬ�ʹ�пƬ����ش��������⣺
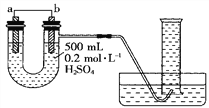
��1��b�缫����Ϊ__________����缫��ӦʽΪ_________________________��
��2������Ͳ���ռ���672 mL(��״����)����ʱ��ͨ�����ߵĵ��ӵ����ʵ���Ϊ__________����ʱa�缫��������__________g��
II��ijͬѧ����ϡ������п��ȡ������ʵ���У����ּ�����������ͭ��Һ�ɼӿ��������������ʡ���ش��������⣺
��1������ʵ���з�����Ӧ�����ӷ���ʽ�У�_____________________________________________��
��2������ͭ��Һ���Լӿ������������ʵ�ԭ����_________________________________________��
��3��Ҫ�ӿ�����ʵ����������������ʣ����ɲ�ȡ�Ĵ�ʩ��_____________________�������֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ú�Ƴ�����ȼ��ú����CO������ҪĿ���ǣ� ��
A. ������
B. ��������
C. ���ȼ��Ч�ʣ����ٴ�����Ⱦ
D. ��Ǯ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ��������Դ֮һ�����б�����ȷ����(����)
A.ˮ�ĵ��������һ�����ȹ���
B.�¶����ߣ���ˮ�е�c(H+)����������
C.ˮ�ĵ���̶Ⱥ�С����ˮ����Ҫ������̬��ˮ����
D.��ˮ�м��������������ˮ�ĵ��룬ʹˮ�����ӻ���С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2008�걱�����˻�����������������ȼ�ϵ���Ҫ�ɷ��DZ��飬�����йر���������в���ȷ����
A.������̼ԭ�Ӳ���һ��ֱ����B.�ȶ������Һ��
C.1mol������ȫȼ������������5molD.�������ܹ�����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ֽ�1 mol H2O�ų�����98kJ���ں�����I������Һ�У�H2O2�ķֽ����Ϊ��
��H2O2��I����H2O��IO�� ��
��H2O2��IO����H2O��O2��I�� ��
�����йط�Ӧ��˵������ȷ����
A.��Ӧ��������I����Ũ���й�B.IO�����Ǹ÷�Ӧ�Ĵ���
C.˫��ˮ�ֽ�����ȡ���ڷ�Ӧ��D.v(H2O2)��v(H2O)��v(O2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ����(����)
A. ��״���£�0.1 mol Cl2����ˮ��ת�Ƶĵ�����ĿΪ0.1NA
B. 25 �棬pH��13��NaOH��Һ�к���OH������ĿΪ0.1NA
C. ��״���£�4.48 L SO3�����ķ�����ĿΪ0.2NA
D. ���³�ѹ�£�16gO2��O3������庬�е���ԭ����ΪNA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com