
| A. | 乙酸的最简式:CH2O | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 苯的结构式:C6H6 | D. | 四溴化碳的电子式: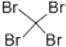 |
分析 A、实验式又称最简式或经验式,是化学式中的一种;用元素符号表示化合物分子中各元素的原子个数比的最简关系式;
B、结构简式就是结构式的简单表达式(通常只适用于以分子形式存在的纯净物,如有机分子),应表现该物质中的官能团,只要把碳氢单键省略掉即可;
C、结构式是表示用元素符号和短线表示化合物(或单质)分子中原子的排列和结合方式的式子;
D、化学中常在元素符号周围用小黑点“.”或小叉“×”来表示元素原子的最外层电子;这种表示的物质的式子叫做电子式.
解答 解:A、乙酸的分子式为:C2H4O2,最简式为:CH2O,故A正确;
B、乙烯的结构简式为:CH2=CH2,故B错误;
C、苯的结构式为 ,故C错误;
,故C错误;
D、四溴化碳的电子式为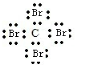 ,故D错误,故选A.
,故D错误,故选A.
点评 本题考查了电子式、结构简式、最简式的书写,题目难度不大,注意掌握常见化学用语的概念及正确的书写方法,明确甲烷与四氯化碳、羟基与氢氧根离子的电子式的区别.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的氧化物与水反应可制得相应的含氧酸 | |
| B. | X、Y、W的最高价氧化物对应水化物之间互相都能发生反应 | |
| C. | X、Y、W的原子半径依次减小,对应的离子半径依次增大 | |
| D. | Z的氢化物的热稳定性强于W的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯),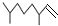 (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2) 8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2) 8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )| A. | 2,4-二甲基-1-庚烯的分子式为C9H18 | |
| B. | 以上三种信息素均能使溴的四氯化碳溶液褪色 | |
| C. | 2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同系物 | |
| D. | 1 mol家蚕的性信息素与1 mol Br2加成,产物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL0.2mol/L氢氧化钠溶液 | B. | 100mL0.3mol/L醋酸溶液 | ||
| C. | 200mL0.2mol/L硫酸溶液 | D. | 150mL0.2mol/L盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.5 kJ•mol-1,则其燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-285.5 kJ•mol-1 | |
| B. | 已知2C(石墨,s)+O2(g)=2CO(g);△H=-221 kJ•mol-1,则石墨的燃烧热为110,5 kJ•mol-1 | |
| C. | 已知N2(g)+3H2(g)?2 NH3(g)△H=-92.4 kJ•mol-1,由于△H<0,故该反应一定能自发进行 | |
| D. | 热化学方程式中的化学计量数表示物质的量,可以是分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在某些工具的机械转动部位刷油漆以防锈 | |
| B. | 衣架和电线外面包上一层塑料层以防锈 | |
| C. | 在钢材制造的大型船舶上装上一定数量的锌块 | |
| D. | 自行车的钢圈和车铃上镀上一层铬,既耐腐蚀又美观耐磨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解池的阳极生成双氧水,阴极生成臭氧 | |
| B. | 电解池中硫酸溶液的pH保持不变 | |
| C. | 产生臭氧的电极反应式为3H2O-6e-=O3+6H+ | |
| D. | 产生双氧水的电极反应式为2H2O-2e-=H2O2+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com