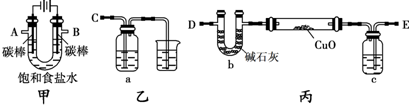
解:(1)电解饱和食盐水阳极是氯离子失电子发生氧化反应生成氯气,阴极是氢离子得到电子发生还原反应,生成氢气,反应的化学方程式为:2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑,
故答案为:2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑;
(2)装置图分析可知,电解饱和食盐水阳极B是氯离子失电子发生氧化反应生成氯气,阴极A是氢离子得到电子发生还原反应,生成氢气,电解产生的H
2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性,装置丙中的E接电解装置中的A;装置乙是验证氯气氧化性的装置,C接电解池的B电极,
故答案为:E;C;
(3)氢气还原氧化铜加热前需要通入氢气把空气赶出,避免空气存在加热发生爆炸,装置中充满氢气在D处检验氢气的纯度,
故答案为:先通一段时间氢气并在D处检验氢气的纯度;
(4)检验氯气的氧化性可以利用还原性的物质发生反应,且有明显的现象,可以把氯气通入淀粉碘化钾溶液发生氧化还原反应,生成碘单质遇淀粉变蓝;多余的氯气是污染性气体需要用氢氧化钠溶液进行吸收处理,反应的离子方程式为:Cl
2+2OH
-=Cl
-+ClO
-+H
2O,
故答案为:淀粉KI溶液;溶液变为蓝色;Cl
2+2OH
-=Cl
-+ClO
-+H
2O;
(5)因为乙方案是测水的质量,氢气中含有水蒸气,通入玻璃管会炸裂玻璃管,需要进行干燥,可以通过浓硫酸吸收水蒸气,
故答案为:浓硫酸;吸收H
2中的H
2O,防止硬质玻璃管炸裂,或影响测定水的质量;
(6)①甲方案是利用反应前后固体物质质量的变化进行计算,乙方案是测定水的质量减小计算,装置D会吸收空气中的水蒸气和二氧化碳使测定结果偏高,
故答案为:甲;空气中的CO
2和H
2O通过D口进入U形管造成实验误差较大;
②精确测量硬质玻璃管的质量为ag,放入CuO后,精确测量硬质玻璃管和CuO的总质量为bg,氧化铜质量=(b-a)g,通过精确测量硬质玻璃管和Cu粉的总质量为c g,铜元素质量=(c-a)g,所以氧元素质量=(b-c)g,设铜相对原子质量为M(Cu),则

=
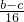
,得到M(Cu)=

,故答案为:

.
分析:(1)电解饱和食盐水阳极是氯离子失电子发生氧化反应生成氯气,阴极是氢离子得到电子发生还原反应,生成氢气,结合产物书写化学方程式;
(2)依据装置图分析可知,电解饱和食盐水阳极B是氯离子失电子发生氧化反应生成氯气,阴极A是氢离子得到电子发生还原反应,生成氢气,电解产生的H
2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性,装置丙中的E接电解装置中的A;装置乙是验证氯气氧化性的装置,D接电解池的B电极;
(3)氢气还原氧化铜加热前需要通入氢气把空气赶出,避免空气存在加热发生爆炸,装置中充满氢气在D处检验氢气的纯度;
(4)检验氯气的氧化性可以利用还原性的物质发生反应,且有明显的现象,可以把氯气通入淀粉碘化钾溶液发生氧化还原反应,生成碘单质遇淀粉变蓝;氯气需要用氢氧化钠溶液吸收;
(5)氢气中含有水蒸气,通入玻璃管会炸裂玻璃管,需要进行干燥,可以通过浓硫酸吸收水蒸气;
(6)①甲方案是利用反应前后固体物质质量的变化进行计算,乙方案是测定水的质量减小计算,装置D会吸收空气中的水蒸气和二氧化碳使测定结果偏高;
②依据甲方案实验数据,利用氧化铜中铜元素物质的量和氧元素物质的量之比等于1:1计算得到铜的相对原子质量.
点评:本题考查了物质性质的验证和物质测定实验设计方案,物质性质的掌握,实验步骤和实验原理的理解是解题关键,题目难度中等.

 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑, 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑; =
=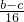 ,得到M(Cu)=
,得到M(Cu)= ,故答案为:
,故答案为: .
.

 某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性.
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性.