
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺
(1)��ͼ��N2��H2��Ӧ����2 mol NH3�����������仯ʾ��ͼ��д������NH3���Ȼ�ѧ����ʽ��________________________________________________________________________��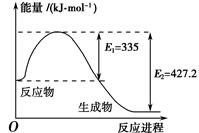
(2)����̬��̬ԭ���γ�1 mol��ѧ���ͷŵ���������м��ܡ��ӻ�ѧ���ĽǶȷ�������
ѧ��Ӧ�Ĺ��̾��Ƿ�Ӧ��Ļ�ѧ�����ƻ���������Ļ�ѧ�����γɹ��̡��ڻ�ѧ��Ӧ��
���У���ѧ����Ҫ�����������γɻ�ѧ���ֻ��ͷ�������
��֪��ӦN2(g)��3H2(g) 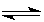 2NH3(g) ��H��a kJ��mol��1��
2NH3(g) ��H��a kJ��mol��1��
�Ը��ݱ������м������ݹ���a����ֵ��________��
| ��ѧ�� | H��H | N��H | N��N |
| ����kJ��mol��1 | 436 | 391 | 945 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����Ȼ�ѧ����ʽ��ȷ���ǣ�ע��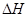 �ľ���ֵ����ȷ��( )
�ľ���ֵ����ȷ��( )
| A��C2H5OH(l)+3O2(g)=2CO2(g) +3H2O(g)����H=" ��1367.0" kJ/mol��ȼ���ȣ� |
| B��NaOH(aq) + HCl(aq)="NaCl(aq)" + H2O(l)����H= ��57.3kJ/mol���к��ȣ� |
| C��S(s) + O2(g) = SO2(g)����H= ��269.8kJ/mol����Ӧ�ȣ� |
| D��2HCl(g)=Cl2(g) + H2(g)����H=" ��" 184.6kJ/mol����Ӧ�ȣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
1������ȼ������Һ̬ˮ�ų�142.9 kJ��������ʾ�÷�Ӧ���Ȼ�ѧ����ʽ��ȷ����( )
| A��2H2(g)+O2(g)=2H2O(l)����H="-285.8" kJ/mol |
| B��H2(g)+1/2O2(g)=H2O(g)����H=-142.9kJ/mol |
| C��H2O(l)=H2(g)+1/2O2(g)�� ��H="+285.8" kJ/mol |
| D��2H2+O2=2H2O����H="-571.6" kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��˹������Ϊ�����ܻ�ѧ������һ����ɻ��Ϊ������ɣ�������̵���ЧӦ����ͬ�ġ�
��֪��H2O��g��=H2O��l����H1 =��Q1kJ/mol
C2H5OH��g��=C2H5OH��l�� ��H2 =��Q2kJ/mol
C2H5OH��g��+3O2��g��=2CO2��g��+3H2O��g�� ��H3 =��Q3kJ/mol
��ʹ0��5mol�Ҵ�Һ����ȫȼ�գ����ָ������£���ų�������Ϊ��kJ��
| A��Q1+Q2+Q3 |
| B��0��5��Q1+Q2+Q3�� |
| C��0��5 Q2��1��5 Q1��0��5Q3 |
| D��1��5 Q1��0��5 Q2+0��5Q3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪(1)H2(g)�� O2(g)��H2O(g)�� DH1��akJ��mol-1
O2(g)��H2O(g)�� DH1��akJ��mol-1
(2)2H2(g)��O2(g)��2H2O(g) �� DH2��b kJ��mol-1
(3)H2(g)�� O2(g)��H2O(l) �� DH3��c kJ��mol-1
O2(g)��H2O(l) �� DH3��c kJ��mol-1
(4)2H2(g)��O2(g)��2H2O(l) �� DH4��d kJ��mol-1
���й�ϵʽ����ȷ����
| A��a��c��0 | B��b��d��0 | C��2a��b��0 | D��2c��d��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���й�������ת������ʶ�в���ȷ����
| A��ԭ��ع���ʱ��ѧ��ȫ��ת��Ϊ���� |
| B����ҵ�ϵ���������Ʊ���������ת���ɻ�ѧ�� |
| C��þ�ڿ�����ȼ��ʱ��ѧ�ܲ�ֻת������� |
| D����ɫֲ�������ù�����̫����ת��ɻ�ѧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ӦA+B��C(��H>0)���������У���A+B��X(��H<0)����X��C(��H>0)������ʾ��ͼ�У�����ȷ��ʾ�ܷ�Ӧ�����������仯����( )
A B C D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ͼΪ��Ӧ2X(g)+Y(s)  2Z(g)�ķ�Ӧ���̺�������ϵͼ������˵����ȷ���ǣ� ��
2Z(g)�ķ�Ӧ���̺�������ϵͼ������˵����ȷ���ǣ� ��
| A������a��b��ʾ������Ӧ���̵ķ�Ӧ�Ȳ�ͬ |
| B������aһ����ʾ��Ӧ��������ʱ�ķ�Ӧ���� |
| C������ѹǿ��X��ת����һ������ |
| D����Ӧ�ﵽƽ��������¶ȣ�ƽ�ⳣ��Kֵһ����С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���й���ȼ���Ⱥ��к��ȵıȽ��У��������
| A�����߶�Ӧ��Ӧ�ġ�H��С��0 |
| B�����ߵĵ�λ��ΪkJ��mol-1����mol��1�ĺ��岻ͬ |
| C�����ߵ���ֵ�����淴Ӧ�������ı���ı� |
| D�����ߵ���ֵ���淴Ӧ��ı���ı� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com