
【题目】某种溶液可能含有下列阴离子中的一种或几种:![]() 、
、![]() 、Cl。
、Cl。
(1)当溶液中有大量H+存在时,则不可能有________存在。
(2)当溶液中有大量Ba2+存在时,溶液中不可能有________存在。
(3)当溶液中有________和________等阳离子存在时,上述所有阴离子都不可能存在。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】钒和镍及其化合物是重要合金材料和催化剂,其储氢合金可作为一种新型锌离子电池的负极材料,该电池以Zn(CF3SO3)2为电解质,以有缺陷的阳离子型ZnMn2O4为电极,成功获得了稳定的大功率电流。
(1)基态钒原子的核外电子排布式为________,其排布时能量最高电子所占据能级的原子轨道有________个伸展方向。
(2)VO2+可与多种物质形成配合物,与氧同周期且第一电离能比氧大的主族元素有____(写元素符号)。
(3)镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为_______,与CN-互为等电子体的一种分子的化学式为__________。
(4)三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF3、H2O2等为主要原料来制取。
①H2O2分子中O原子的杂化方式为________。
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为__________。

(5)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2所示,该晶胞中S2-的配位数为____。
(6)镧镍合金是重要储氢材料,其储氢后的晶胞如图3所示。
①储氢前该镧镍合金的化学式为___________。
②该镧镍合金储氢后氢气的密度为________(用NA表示阿伏加德罗常数的数值)g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数K随温度的变化如下表:
H2(g)+CO2(g)平衡常数K随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题
(1)该反应的平衡常数表达式K= ,△H 0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2(g)![]() 2CO(g)平衡常数K1
2CO(g)平衡常数K1
C(s)+H2O(g)![]() H2(g)+CO(g)平衡常数K2,
H2(g)+CO(g)平衡常数K2,
则K、K1、K2,之间的关系是 。
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为 ;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正 v逆 (填“>”、“=”或“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图l所示:

①在0~30小时内,CH4的平均生成速率vI、vⅡ和vⅢ从小到大的顺序为________;反应开始后的12小时内,在第____种催化剂的作用下,收集的CH4最多。
②将所得的CH4与H2O(g)通入聚焦太阳能反应器,发生CH4(g)+H2O(g)![]() CO(g)+3H2(g)反应,在一定条件下,CH4的平衡转化率与温度、压强的关系如图2所示,T2>T1,则上述反应的△H _______0(填“<”、“>”、“=”,下同),A、C处对应平衡常数(KA、KC)的大小关系为KA____KC。
CO(g)+3H2(g)反应,在一定条件下,CH4的平衡转化率与温度、压强的关系如图2所示,T2>T1,则上述反应的△H _______0(填“<”、“>”、“=”,下同),A、C处对应平衡常数(KA、KC)的大小关系为KA____KC。
③维持温度T2,将0.04mol CH4(g)和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=________。
④下列现象能说明该反应已经达到平衡状态的是________(填编号)。
A.容器内CH4、H2O、CO、H2单位物质的量之比为1:1:1:3
B.容器内气体的密度恒定
C.容器内气体的压强恒定
D.3v( CO)=v(H2)
(2)LiBH4为近年来常用的储氢材料。
①反应2LiBH4 =2LiH+2B +3H2↑,生成22.4 L H2(标准状况)时,转移电子的物质的量为____ mol。
②图3是2LiBH4/MgH2体系放氢焓变示意图,则:Mg(s) +2B(s) =MgB2(s) △H=____。
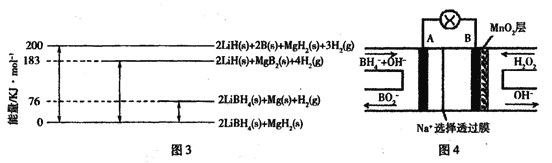
(3)图4是直接硼氢化钠一过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH___(填“增大”、“减小”或“不变”),负极的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质之间有下图所示的转化关系。已知:A是空气中的主要成分,B、C、D均为化合物,且C与水反应可得到B。
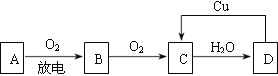
请回答下列问题:
(1)写出B的名称:_______________________。
(2)在上图D→C的过程中,Cu在反应中________(填“被氧化”或”被还原”)。
(3)在D的稀溶液中滴入Na2CO3溶液,其反应的离子方程式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 焓变是一个反应能否自发进行相关的因素,多数放热反应能自发进行
B. 在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大
C. 自发进行的反应一定能迅速进行
D. 一个反应能否自发进行,与焓变和熵变的共同影响有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是________,可能含有的物质是________(以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加___________________溶液的方法来检验。
(2)写出步骤③中的离子方程式__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L
CH3COOH溶液滴定曲线如右图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+ c(OH-) =c(CH3COOH)+ c(H+)
B. 点②所示溶液中:c(Na+) =c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
D. 滴定过程中可能出现:c(CH3COOH)> c(CH3COO-)> c(H+)> c(Na+)> c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com