
硫酸是工业生产中重要的产品之一,以黄铁矿为原料生产硫酸的简单流程如下图所示。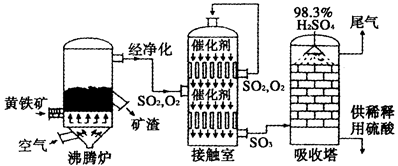
请填写下列空白。
(1)黄铁矿燃烧生成SO2的化学方程式为_____________;接触室中发生反应的化学方程式为____________________。
(2)为充分利用反应放出的热量,接触室中应安装_____________(填设备名称);吸收塔中填充有许多瓷管,其作用为__________________。
(3)为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO2的体积分数为____________________(设空气中氧气的体积分数为0.20);将上述炉气经净化除尘后直接送入接触室,流量为1.00m3/s,从接触室导出气体的流量为0.95m3/s(同温同压下测定),则SO2的转化率为________________%。
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式为___________________。
(5)硫酸的用途非常广泛,可应用于下列____________(可多选)。
a.橡胶的硫化 b.过磷酸钙的制备
c.铅蓄电池的生产 d.表面活性剂“烷基苯磺酸钠”的合成
(15分)4FeS2+11O2 4Fe2O3+8SO2(2分) 2SO2+O2
4Fe2O3+8SO2(2分) 2SO2+O2 2SO3(2分)
2SO3(2分)
(2)热交换器(1分) 增加SO3与浓硫酸的接触面,有利于SO3的吸收(1分)
(3)0.108(2分) 92.6(2分)
(4)SO2+Br2+2H2O=4H++2Br-+SO42-(2分) (5)b c d(3分)
解析试题分析:(1)黄铁矿燃烧燃烧生成SO2和氧化铁,反应的化学方程式为FeS2+11O2 4Fe2O3+8SO2;接触室中发生反应的化学方程式为2SO2+O2
4Fe2O3+8SO2;接触室中发生反应的化学方程式为2SO2+O2 2SO3。
2SO3。
(2)为充分利用反应放出的热量,接触室中应安装热交换器;吸收塔中填充有许多瓷管,可以增加反应物的接触面积,加快反应速率,即作用为增加SO3与浓硫酸的接触面,有利于SO3的吸收。
(3)设二者恰好反应时需要空气的体积是x,则
4FeS2+11O2 4Fe2O3+8SO2
4Fe2O3+8SO2
11 8
0.2x 1.6x/11
则反应后SO2的体积分数是 =0.108
=0.108
2SO2+O2 2SO3 △V↓
2SO3 △V↓
2 1 2 1
0.1 1-0.95
所以SO2的转化率是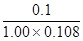 ×100%=92.6%
×100%=92.6%
(4)单质溴具有氧化性,能把SO2氧化生成硫酸,反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-。
(5)硫酸的用途非常广泛,主要用于过磷酸钙的制备、铅蓄电池的生产表面活性剂“烷基苯磺酸钠”的合成,橡胶的硫化用的是单质硫,答案选bcd。
考点:考查硫酸的工业制备、计算、反应条件的控制以及硫酸的用途、SO2的吸收


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。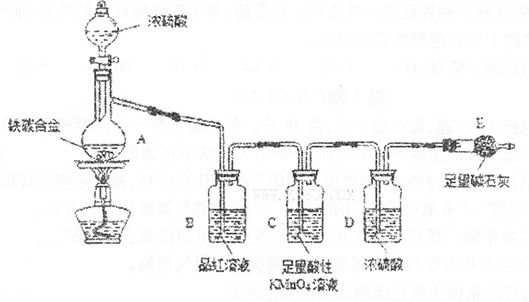
I.测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根
导管,然后________________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。铁碳合金中铁的质量分数为_____________________________________________(写表达式)。
(3)装置C中反应的离子方程式为________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、H2O进入E管使b增大。你认为改进的方法是____________________________________.
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分
数也可能会偏离。你认为其中的原因是_________________________________________。
Ⅱ.探究浓硫酸的某些性质:
(6)往A中滴加足量的滚硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
_____________________________________________________________________。
(7)将A中固体换为金属铜则与浓硫酸发生反应的化学方程式是__________________
_______________________,反应中浓硫酸表现出的性质是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究。
(1)[提出假设]向一定量的过氧化钠固体中通入足量的SO2,对反应后的固体产物成分及反应原理提出如下假设:
假设一:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设二:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设三:反应后固体中____________ _____,证明 。
(2)[定性研究]
为验证假设三是否成立,兴趣小组进行如下研究,请你完成下表中内容
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取反应后的固体放入试管中,…… | |
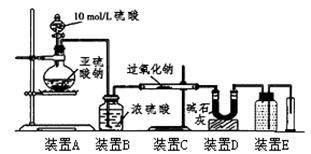
| SO2被氧化的程度 | V与m1或m2的关系 |
| 完全被氧化 | V=0 |
| 部分被氧化 | |
| 未被氧化 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: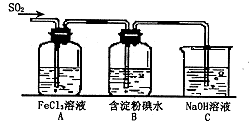
(1)SO2气体与Fe3+反应的主要产物是____、 。(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是 。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。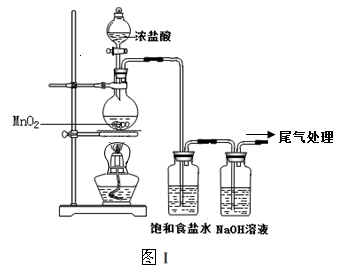

实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中反应的化学方程式是 。
(2)饱和食盐水的作用是 。
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。
查阅资料:在溶液中发生反应:
(a)Cl2(g)+2NaOH(aq)═ NaCl(aq)+NaClO(aq)+H2O(l)??H1=-101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO3(aq)??H2=-112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢
根据资料,请对图Ⅰ装置提出改进建议: 。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液。他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:ⅰ.NaClO把Na2SO3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是 。
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知A、B为单质,C为化合物。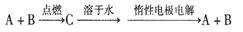
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若C溶液中滴加过量NaOH溶液,先出现浑浊后澄清,则B可能为Al
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
能实现上述转化关系的是
A.①② B.②④ C.①③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。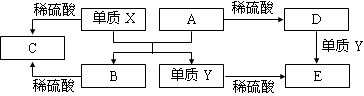
则下列说法正确的是
A.X与A反应的化学方程式是:Al2O3 + 2Fe Fe2O3 + 2Al
Fe2O3 + 2Al
B.检验D溶液中的金属阳离子的反应:Fe3++3SCN—=Fe(SCN)3↓
C.单质Y在一定条件下能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,如图所示的相互反应,图中每条连线两端的物质可以发生化学反应。下列说法不合理的是( )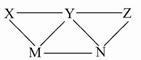
| A.X一定为KHSO4 | B.Y一定为Na2CO3 |
| C.Z可能是氯水 | D.M、N必定各为BaCl2、FeSO4中的一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com