
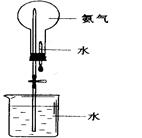
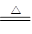 CaCl2 + 2NH3↑ + 2H2O 红色石蕊 试纸变蓝
CaCl2 + 2NH3↑ + 2H2O 红色石蕊 试纸变蓝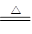 CaCl2 + 2NH3↑ + 2H2O。氨气是一种碱性气体,溶于水显碱性,所以可用用湿润的红色石蕊试纸靠近集气瓶口,而现象则是试纸变为蓝色。
CaCl2 + 2NH3↑ + 2H2O。氨气是一种碱性气体,溶于水显碱性,所以可用用湿润的红色石蕊试纸靠近集气瓶口,而现象则是试纸变为蓝色。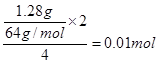 。
。

科目:高中化学 来源:不详 题型:实验题
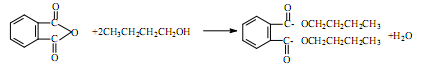
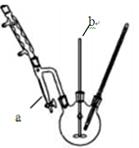
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
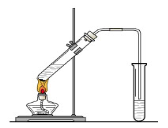
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制取溴苯:将铁屑、溴水、苯混合加热 |
| B.实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 |
| C.鉴别甲苯和苯:向甲苯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色 |
| D.检验卤代烃中的卤原子:加入NaOH溶液共热,再加AgNO3溶液,观察沉淀的颜色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净 |
| B.上述变化过程中包括了分解、化合、复分解、置换等四种反应类型 |
| C.在氯化氢热气流中干燥晶体的目的是为了加快干燥速度 |
| D.步骤⑤也可以采用电解该盐水溶液的方法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
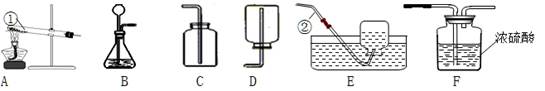
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.④③⑦⑤⑥ | B.②⑤⑦⑥ | C.①③⑤⑥⑦ | D.②⑥③⑦⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 KMnO4 + H2C2O4 + ( )---K2SO4 + CO2↑+ MnSO4 + ( )
KMnO4 + H2C2O4 + ( )---K2SO4 + CO2↑+ MnSO4 + ( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com