
 KMnO4 + H2C2O4 + ( )---K2SO4 + CO2↑+ MnSO4 + ( )
KMnO4 + H2C2O4 + ( )---K2SO4 + CO2↑+ MnSO4 + ( )



科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.可以按此建议改进,便于使用容量瓶 |
| B.不能按此建议改进,因为会降低容量瓶的精确度 |
| C.如果加粗瓶颈,可将原来刻在容量瓶瓶颈上的刻度线改刻在容量瓶的瓶身上 |
| D.不必加粗瓶颈,因为向容量瓶中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响 |
查看答案和解析>>
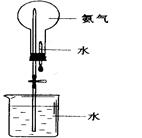
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5~9 | B.4.0~10.0 | C.4.3~9.7 | D.以上都不正确 |
查看答案和解析>>
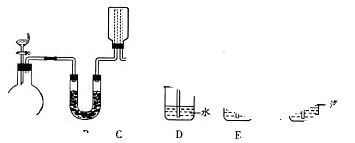
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制一定体积的物质的量浓度溶液,定容时仰视,会使浓度偏低 |
| B.盛装水玻璃和氢氧化钠溶液的试剂瓶,都不能使用磨口玻璃塞 |
| C.向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有吸水性 |
| D.常温下,浓硝酸可用铝罐来贮存,说明浓硝酸具有强氧化性 |
查看答案和解析>>
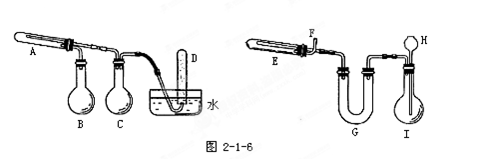
科目:高中化学 来源:不详 题型:实验题
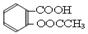 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: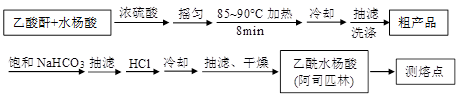
| 名 称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
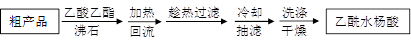 改进的提纯方法中加热回流的装置如图所示
改进的提纯方法中加热回流的装置如图所示
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (NH4)2S2O8+H2↑,
(NH4)2S2O8+H2↑, 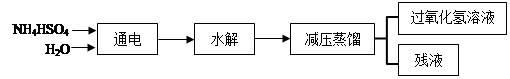
| A.不稳定性 | B.弱碱性 | C.氧化性 | D.还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com