
| A、外观透明 |
| B、有丁达尔效应 |
| C、不稳定 |
| D、分散质粒子直径为:10-9m~10-7m |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、NF3是氧化剂,H2O是还原剂 |
| B、还原剂和氧化剂的物质的量之比是2:1 |
| C、若生成0.2mol HNO3,则转移0.4mol电子 |
| D、NF3在潮湿的空气中泄漏会产生红棕色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳的燃烧热大于110.5 kJ/mol |
| B、①的反应热为221 kJ/mol |
| C、稀硫酸与稀NaOH溶液反应的中和热为114.6 kJ/mol |
| D、稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe能溶于FeCl3溶液:Fe+Fe3+═2Fe2+ |
| B、Cl2的氧化性强于Br2:Cl2+2Br-═2Cl-+Br2 |
| C、Na与H2O反应产生气体:2Na+2H2O═2Na++2OH-+H2↑ |
| D、Na2SiO3溶液与盐酸反应生成硅酸凝胶:SiO32-+2H+═H2SiO3(胶体) |
查看答案和解析>>
科目:高中化学 来源: 题型:
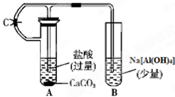 根据如图所示装置,请回答:
根据如图所示装置,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水常温下呈液态,冰浮在水上,均与氢键有关 | ||||
| B、用于航天工业的氢氧燃料电池的电解质,使用H2SO4的效果比KOH好 | ||||
| C、SO2、氮氧化物和可吸处颗粒物是造成雾霾的一个重要原因 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
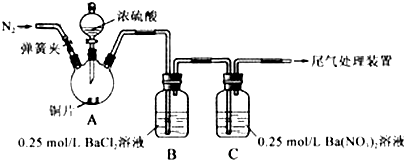
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2, 停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入Ba(NO3)2溶液生成白色沉淀,加入稀盐酸后沉淀不消失,则原溶液中一定含有SO42- |
| B、通入氯气后,溶液变黄色,加入淀粉溶液后变蓝,则原溶液中一定有I- |
| C、加入碳酸钠溶液有白色沉淀生成,再加入盐酸,沉淀消失,则原溶液中一定含有Ba2+ |
| D、加入氢氧化钠溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则原溶液中一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
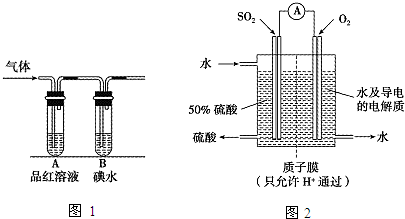
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com