
| A、Fe能溶于FeCl3溶液:Fe+Fe3+═2Fe2+ |
| B、Cl2的氧化性强于Br2:Cl2+2Br-═2Cl-+Br2 |
| C、Na与H2O反应产生气体:2Na+2H2O═2Na++2OH-+H2↑ |
| D、Na2SiO3溶液与盐酸反应生成硅酸凝胶:SiO32-+2H+═H2SiO3(胶体) |


科目:高中化学 来源: 题型:
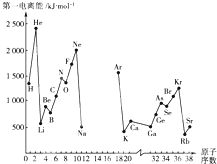 根据信息回答列问题:
根据信息回答列问题:| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、200mL 1mol/L的NaCl溶液中阴阳离子总数为0.2NA |
| B、标准状况下,11.2L乙醇中的分子数为0.5NA |
| C、58.5gNaCl完全溶于2L水中,得到NaCl溶液的物质的量浓度为0.5mol/L |
| D、1mol金属Na与足量的O2反应生成Na2O和Na2O2混合物,Na失去的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烧碱溶液与碳酸氢钠溶液:HCO3-+OH-=H2O+CO2↑ |
| B、氧化钠与盐酸:O2-+2H+=H2O |
| C、碳酸氢钠与稀硫酸:CO32-+2H+=H2O+CO2↑ |
| D、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
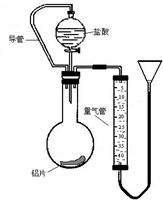 (1)在探究铝和盐酸反应的实验现象是:“向铝片滴加盐酸,开始铝片表面出现少量气泡,而且气泡越来越多,甚至于使酸液‘沸腾’起来.”请解释上述现象.
(1)在探究铝和盐酸反应的实验现象是:“向铝片滴加盐酸,开始铝片表面出现少量气泡,而且气泡越来越多,甚至于使酸液‘沸腾’起来.”请解释上述现象.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com