
| A、加热氯化铵 |
| B、干冰气化 |
| C、熔融氯化钠导电 |
| D、氯化氢溶于水 |
| ||


科目:高中化学 来源: 题型:
| A、1mol/L甲酸溶液中c(H+)约为1×10-2mol/L |
| B、甲酸能与水以任意比互溶 |
| C、10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 |
| D、甲酸的导电性比强酸溶液的导电性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳的燃烧热大于110.5 kJ/mol |
| B、①的反应热为221 kJ/mol |
| C、稀硫酸与稀NaOH溶液反应的中和热为114.6 kJ/mol |
| D、稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe能溶于FeCl3溶液:Fe+Fe3+═2Fe2+ |
| B、Cl2的氧化性强于Br2:Cl2+2Br-═2Cl-+Br2 |
| C、Na与H2O反应产生气体:2Na+2H2O═2Na++2OH-+H2↑ |
| D、Na2SiO3溶液与盐酸反应生成硅酸凝胶:SiO32-+2H+═H2SiO3(胶体) |
查看答案和解析>>
科目:高中化学 来源: 题型:
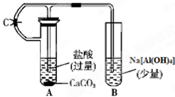 根据如图所示装置,请回答:
根据如图所示装置,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
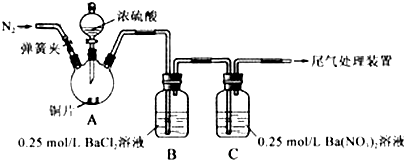
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2, 停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、红色激光束能透过小烧杯中的氢氧化铁胶体,但不能透过小烧杯中较浓的硫酸铜溶液 |
| B、胶体的丁达尔效应是胶体粒子对可见光散射而形成的 |
| C、胶体化学是随20世纪未纳米科技兴起而产生的 |
| D、纳米粒子的大小与胶体粒子相当,但纳米粒子的体系不一定是胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com