
【题目】如图是实验室制取乙烯,并用来验证乙烯化学性质的实验装置,其中B中盛放的是溴水,C中盛放的是酸性KMnO4溶液。
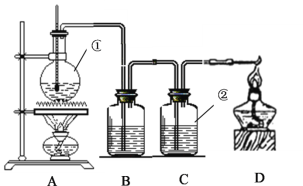
(1)写出①中发生反应的化学方程式____________________________________,
(2)B瓶中的现象是__________________,C瓶中的现象是__________________,这两种现象可以证明乙烯是_____________。(填“饱和烃”或“不饱和烃”)
(3)写出B瓶中发生反应的方程式_______________________________________。
【答案】CH3CH2OH![]() CH2=CH2↑+H2O 褪色 褪色 不饱和烃 CH2=CH2 + Br2 → CH2Br—CH2Br
CH2=CH2↑+H2O 褪色 褪色 不饱和烃 CH2=CH2 + Br2 → CH2Br—CH2Br
【解析】
(1)有装置可知是制乙烯的,可以写出反应的化学方程式;
(2)B瓶用溴水吸收乙烯;C瓶乙烯使酸性高锰酸钾褪色;
(3)根据乙烯的性质可以写出化学反应方程式。
(1)实验室制取乙烯用的是乙醇和浓硫酸混合加热170度,①中发生反应的化学方程式CH3CH2OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
(2)乙烯使溴水褪色,故B瓶的现象是褪色,乙烯能与酸性高锰酸钾反应,故C瓶现象是褪色;这两种现象可以证明乙烯是 “不饱和烃”;
(3)乙烯与溴水发生反应的方程式是CH2=CH2 + Br2 → CH2Br—CH2Br。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,一定条件下发生反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能减排已经成为全社会的共识,浙江省在原先推行乙醇汽油的基础上,开始试点甲醇汽油![]() 即在汽油中添加一定量的甲醇
即在汽油中添加一定量的甲醇![]() ,根据检测的数据分析认为,若宁波全市的140余万辆机动车全部使用甲醇汽油,一年内能减少有害气体
,根据检测的数据分析认为,若宁波全市的140余万辆机动车全部使用甲醇汽油,一年内能减少有害气体![]() 一氧化碳
一氧化碳![]() 排放将近100万吨。甲醇常利用煤气化过程中生成的CO和
排放将近100万吨。甲醇常利用煤气化过程中生成的CO和![]() 来制备:CO+2H2
来制备:CO+2H2![]() CH3OH,
CH3OH,

请根据图示回答下列问题:
(1)关于该反应的下列说法中,正确的是______![]() 填字母
填字母![]() :
:
A.![]() ,
,![]()
![]() ,
,![]() C.
C.![]() ,
,![]()
![]() ,
,![]()
(2)现进行如下实验,在体积为1L的密闭容器中,充入1molCO和![]() ,净测得CO和
,净测得CO和![]() 的浓度随时间变化如图所示,从反应开始到平衡,CO的平均反应速率υ(CO)=______,该反应的平衡常数
的浓度随时间变化如图所示,从反应开始到平衡,CO的平均反应速率υ(CO)=______,该反应的平衡常数![]() ______。
______。
(3)判断该可逆反应达到化学平衡状态的标志是______(填字母)。
a.υ生成(CH3OH)=υ消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
e. 混合气体的压强不再改变
(4)恒容条件下,达到平衡后,下列措施中能使![]() 增大的有______。
增大的有______。
A.升高温度 B.充入He气 C.再充入1molCO和![]() D.使用催化剂
D.使用催化剂
(5)若在一恒容的密闭容器中充入1molCO和![]() ,达到平衡时测的混合气体的压强是同温同压下起始的0.6倍(此过程三种物质均处于气态)则平衡时混合气体的平均摩尔质量
,达到平衡时测的混合气体的压强是同温同压下起始的0.6倍(此过程三种物质均处于气态)则平衡时混合气体的平均摩尔质量![]() ______
______![]() 。(结果保留3位有效数字)
。(结果保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内的血红蛋白(Hb)和肌红蛋白(Mb)均可与O2结合,Hb也可以与CO结合。
已知:反应①:Hb(aq)+O2(g)![]() HbO2(aq) H1<0;
HbO2(aq) H1<0;
反应②:Hb(aq)+CO(g)![]() HbCO(aq) H2<0
HbCO(aq) H2<0
反应③:HbO2(aq)+CO(g)![]() HbCO(aq)+O2(g) H3
HbCO(aq)+O2(g) H3
(1)H3=_____(用H1、H2表示);反应③自发进行的趋势较大,则H1_____H2(填“>”、“<”或“=”)
(2)CO中毒者应立即转移至空气新鲜的地方,结合反应③,从平衡移动的原理分析这样做的理由是_____。
(3)肌红蛋白结合O2的化学方程式为Mb(aq)+O2(g) ![]() MbO2(aq) H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
MbO2(aq) H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
①对于CO中毒的病人,为解毒需要将v正提高到正常人的4倍,假设病人体内c(Mb)与常人相同,空气中p(O2)为20.0kPa,则解毒时提供病人呼吸的O2的压强是__________。
②该反应平衡总数的表达式为![]() ,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=_______,a(Mb)=________(用含p(O2)的式子表示)。
,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=_______,a(Mb)=________(用含p(O2)的式子表示)。

③ T℃时,![]() kPa-1,则T______37(填“>”、“<”或“=”),理由是________________。
kPa-1,则T______37(填“>”、“<”或“=”),理由是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:
(1)将N2转化为含氮化合物的过程称为固氮
① 人工固氮,将N2→NH3, N2发生_________反应
② 自然界固氮,可将少量N2转化为Ca(NO3)2等氮肥,转化途径如下(转化所需试剂及条件已略去):N2→NO→NO2→HNO3![]() Ca(NO3)2。写出NO→NO2→HNO3的化学方程式__________、__________。将HNO3转化为Ca(NO3)2,列举三种不同类别的化合物M_______(写化学式)。
Ca(NO3)2。写出NO→NO2→HNO3的化学方程式__________、__________。将HNO3转化为Ca(NO3)2,列举三种不同类别的化合物M_______(写化学式)。
(2)科学合理地保存、施用氮肥
① NH4HCO3需阴凉处保存,原因是__________(写化学方程式)。
② 铵态氮肥不能与碱性肥料混合使用,以NH4Cl为例写出发生反应的离子方程式________。
(3)过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。(NH4)2SO4是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去):
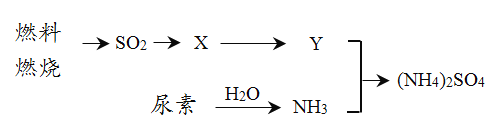
① X可能是______、_______。 Y是___________。
② 尿素CO(NH2)2是一种常用化肥,缓慢与H2O发生非氧化还原反应释放出NH3则尿素中C元素化合价为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里研究不同价态硫元素之间的转化
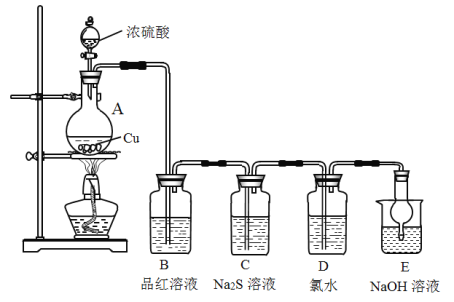
(1)A中发生反应的化学方程式为__________。
(2)B中的现象是__________。
(3)C中的现象是__________,Na2S在反应中做__________剂。
(4)D中氯水褪色,此反应中硫元素的化合价由_____转化为______;甲认为可以补充一个实验进一步证明硫元素的价态转化,实验方案和现象为:取D中褪色后的溶液于试管中________。
(5)E的作用是__________,离子方程式为__________。
(6)上述实验体现SO2的性质有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 依据铝热反应原理,能发生反应2Al+3MgO![]() 3Mg+Al2O3
3Mg+Al2O3
B. 在加入铝粉能放出氢气的溶液中,K+、NH4+、CO32-、Cl-一定能够大量共存
C. 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液
D. 氯化铝溶液中加入过量氨水反应实质是:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.常温常压下,32 g氧气所含的原子数为NA
B.标准状况下,22.4 L 四氯化碳的分子数为NA
C.0℃,101 kPa下,44.8 L氮气所含有的分子数为2NA
D.常温常压下,1 mol氦气含有的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】管道工人曾经用浓氨水检查氯气管道是否漏气,发生反应:8NH3+3Cl2=6NH4Cl+N2。下列叙述正确的是( )
A.NH3的电子式为![]()
B.每转移3NA电子时,消耗Cl2的体积为33.6L
C.该检验过程有共价键、离子键的断裂与生成
D.用该方法检验管道泄漏处会产生白烟
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com