
某元素的单质甲及其化合物乙、丙、丁、戊在一定条件下发生如图所示变化,则化合物丁可能是

[ ]
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 纵行 横行 |
1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
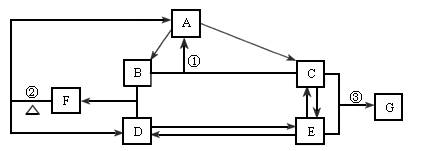
已知:F可用作化肥,也可用来制炸药;纯净的G是一种无色或淡黄色的晶体。据此判断:
(1)单质A必定是________(填“金属”或“非金属”),理由是________。
(2)指出反应①在现代化学工业上的实际意义________。
(3)已知反应②是氧化还原反应,其氧化产物与还原产物的质量比为________。
(4)写出反应③的离子方程式________。
(5)下列哪些属于物质G的用途________。
a.用于印染、漂白行业
b.粘合剂
c.防腐剂
d.“钡餐”
e.常用的混凝土掺和剂、防冻剂
f.加入NaI或KIO3后可作“碘盐”用
查看答案和解析>>
科目:高中化学 来源: 题型:043
下图是某元素的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去)。

已知:F可用作化肥,也可用来制炸药;纯净的G是一种无色或淡黄色的晶体。据此判断:
(1)单质A必定是________(填“金属”或“非金属”),理由是________。
(2)指出反应①在现代化学工业上的实际意义________。
(3)已知反应②是氧化还原反应,其氧化产物与还原产物的质量比为________。
(4)写出反应③的离子方程式________。
(5)下列哪些属于物质G的用途________。
a.用于印染、漂白行业
b.粘合剂
c.防腐剂
d.“钡餐”
e.常用的混凝土掺和剂、防冻剂
f.加入NaI或KIO3后可作“碘盐”用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com