
能正确表示下列反应的离子方程式的是
A.NaOH溶液中加入铝片:Al+2OH-=AlO2-+H2↑
B.NaHCO3溶液水【解析】
HCO3-+H2O H3O+ +CO32-
H3O+ +CO32-
C.NH4HCO3溶液与足量烧碱溶液混合:HCO3-+OH-=CO32-+H2O
D.硫酸溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源:2013-2014内蒙古鄂尔多斯市高一下学期期末质量检测化学试卷(解析版) 题型:选择题
根据下列反应事实:①X+Y2+=X2++Y;②Z+2H2O(冷)=Z(OH)2+H2↑;
③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、
Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为
A.X>Z>Y>W B.Z>W>X>Y C.Z>Y>X>W D.Z>X>Y>W
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省红河州高三下学期毕业生复习统一检测理综化学试卷(解析版) 题型:填空题
(15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
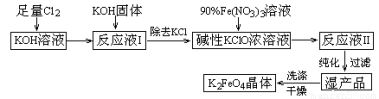
已知:① 2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4可作为新型多功能水处理剂的原因 ;
(4)与MnO2 — Zn电池类似,K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。
(5)在“反应液I ”中加KOH固体的目的是① ,② ;
(6)从“反应液II ”中分离出K2FeO4后,副产品是 (写化学式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L苯中含有的C-H键的数目为0.6NA
B.标准状况下,由H2O2分解制得4.48LO2转移的电子数目为0.8NA
C.14 g 由乙烯与环丙烷(C3H6)组成的混合气体含有的碳原子数目为NA
D.常温下,1 L pH=2的H2SO4溶液中含有的H+数目为0.02NA
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.同一主族元素的气态氢化物,其相对分子质量越大,对应的熔、沸点一定越高
B.升高温度可加快反应速率,其主要原因是反应物分子能量增加,单位体积活化分子的数目增多,活化分子的百分数不变,使得有效碰撞次数增多
C.若R2-离子和M+离子的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的pH:NaA<NaB
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列有关化学键与晶体结构说法正确的是
A.两种元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高三5月校统测理科综合化学试卷(解析版) 题型:填空题
(14分)催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
⑴人们常用催化剂来选择反应进行的方向。下图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成 (填“CO、CO2或HCHO”)。

②2HCHO(g)+O2(g)=2CO(g)+2H2O(g)
△H= 。
③在稀硫酸催化下,HCHO可以通过反应生成分子式为C3H6O3的环状三聚甲醛分子,其分子中同种原子的化学环境均相同。写出三聚甲醛的结构简式: 。
④甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
⑵一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为
g。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。

查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高一下学期期末考试化学试卷(解析版) 题型:选择题
在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:
A(s)+2B(g) C(g)+D(g) 已达平衡的是
C(g)+D(g) 已达平衡的是
A.混合气体的压强 B.混合气体的密度
C.生成l mol C的同时生成l mol D D.气体的总物质的量
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市黄浦区高三二模化学试卷(解析版) 题型:简答题
(本题共12分)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:

29.配平反应中各物质的化学计量数,并标明电子转移方向和数目。
30.该反应的氧化剂是 ,其还原产物是 。
31.上述反应进程中能量变化示意图如下,试在图像中用虚线表示在反应中使用催化剂后能量的变化情况。


32.该反应的平衡常数表达式为K= 。升高温度,其平衡常数 (选填“增大”、“减小”或“不变”)。
33.该化学反应速率与反应时间的关系如上图所示,t2时引起v正突变、v逆 渐变的原因是
,t3引起变化的因素为 ,t5时引起v逆大变化、v正小变化的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com