
(本题共12分)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:

29.配平反应中各物质的化学计量数,并标明电子转移方向和数目。
30.该反应的氧化剂是 ,其还原产物是 。
31.上述反应进程中能量变化示意图如下,试在图像中用虚线表示在反应中使用催化剂后能量的变化情况。


32.该反应的平衡常数表达式为K= 。升高温度,其平衡常数 (选填“增大”、“减小”或“不变”)。
33.该化学反应速率与反应时间的关系如上图所示,t2时引起v正突变、v逆 渐变的原因是
,t3引起变化的因素为 ,t5时引起v逆大变化、v正小变化的原因是 。
 29.
29.
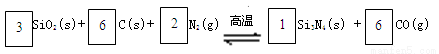
(配平1分,标明电子转移方向和数目共1分)
30. 氮气 氮化硅(化学式同样给分) (2分)
31. 起点、终点与原图像一致(1分),波峰的高度比原图像低(1分)。图示答案略。
32. K=[c(CO)]6/[c(N2)]2 (1分) 减小(1分)
33. 增大了氮气的浓度(1分) 加入(使用)了(正)催化剂(1分)
升高温度或缩小容器体积(2分)
【解析】
试题分析:30、该反应中碳化合价由0价到+2,氮元素由0价变为-3价,氮气为氧化剂,氮化硅为还原产物;31、催化剂不改变反应能量变化但可以降低反应活化能,即起点、终点与原图像一致,波峰的高度比原图像低;32、由图确定该反应为放热反应,升高温度平衡逆向移动,平衡常数变小;33、t2时图像逆反应速率没变,正反应速率增大应为增加气态反应物浓度,t3时反应速率增大,平衡不移动,(而且方程式化学计量数不等不是压强改变)应该是使用正催化剂;t5时反应速率均增大,且逆反应速率大于正反应速率,应为升高温度或缩小容器体积增大压强。
考点:考查化学平衡有关问题。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式的是
A.NaOH溶液中加入铝片:Al+2OH-=AlO2-+H2↑
B.NaHCO3溶液水【解析】
HCO3-+H2O H3O+ +CO32-
H3O+ +CO32-
C.NH4HCO3溶液与足量烧碱溶液混合:HCO3-+OH-=CO32-+H2O
D.硫酸溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省昭通市毕业生复习统一检测理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是
A.已知2SO2(g)+ O2(g) 2SO3 (g) △H<0,该反应在任何温度下均可自发进行
2SO3 (g) △H<0,该反应在任何温度下均可自发进行
B.0.01 mol·L-1NaHCO3溶液中c(Na+)= c(HCO3 -)+ 2c(CO32-)+ c(H2CO3)
C.25℃,0.1mol·L-1 K2CO3溶液中c(H+)/ c(OH-) =l.0 × l0-a,该溶液的pH=7+0.5a
D.室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1 AgNO3溶液,先生成Ag2CrO4沉淀
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市黄浦区高三二模化学试卷(解析版) 题型:计算题
(本题共15分)
有4种质量比可能相同或不同的镁铝合金样品①、②、③、④。甲、乙、丙、丁4位同学各取1种样品,进行下列实验,测定合金中镁的质量分数。
52.甲同学取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则样品①合金中镁的质量分数为_____________。
53.乙同学取样品②m2 g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m2 g。则样品②合金中镁的质量分数为____________。
54.丙同学取样品③m3 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则样品③中m3的取值范围是___________________________________________。
丁同学取不同质量的样品④分别和30 mL同浓度的盐酸反应,所取合金质量与产生气体体积(已转化为标准状况)如下:
实验序号 | a | b | c |
合金质量/mg | 510 | 765 | 918 |
气体体积/mL | 560 | 672 | 672 |
55.通过计算求该盐酸的物质的量浓度。
56.通过计算求样品④中合金中镁的质量分数。
57.在c组实验后,还需向容器中加入1.0 mol·L-1的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市黄浦区高三二模化学试卷(解析版) 题型:选择题
现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:

有关说法错误的是
A.反应Ⅰ原理为CO2 + NH3 + NaCl + H2O → NaHCO3↓ + NH4Cl
B.向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3
C.反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱
D.往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市黄浦区高三二模化学试卷(解析版) 题型:选择题
已知NaCN溶液呈碱性,(CN)2与卤素单质的性质相似,CN-的还原性介于Br-、I-之间。下列变化不能发生的是
A.HCN  H++CN-
H++CN-
B.(CN)2+CH2==CH2 → NC—CH2—CH2—CN
C.(CN)2+2Br- → 2CN-+Br2
D.(CN)2+2OH- → CN-+CNO-+H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市静安区第二学期高二学业水平测试化学试卷(解析版) 题型:填空题
氯是重要的非金属元素。
30.NaCl和浓硫酸微热制取氯化氢的化学方程式为 ;
可用 试纸放在瓶口以检验氯化氢气体是否集满。
31.新制氯水中含有的分子有:Cl2、H2O和 ;光照新制氯水的化学方程式为 ;工业是用电解食盐水制取氯气,阴极的电极反应式为:
2H++2e→H2↑, 则阳极的电极反应式为 。
32.已知还原性SO32->I->Br-.向NaBr、NaI、Na2SO3混合溶液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是______(选填编号)。
a. NaCl Na2SO4 b. NaCl NaBr Na2SO4
c. NaCl Na2SO4 I2 d. NaCl NaI Na2SO4
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市宝山区高二年级化学学科质量监测化学试卷(解析版) 题型:选择题
下列物质中,互为同系物的是
A. CH≡C—CH3与CH3—CH=CH2 B. CH3—CH=CH2与CH3—CH2—CH=CH2
C. CH3COOH与CH3CH2OH D. CH3OH与CH3CHO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com