
�����15�֣�
��4�������ȿ�����ͬ��ͬ��þ���Ͻ���Ʒ�������������ܡ��ס��ҡ�������4λͬѧ��ȡ1����Ʒ����������ʵ�飬�ⶨ�Ͻ���þ������������
52����ͬѧȡ��Ʒ��m1 g����������������Һ��Ӧ��Ȼ����ˣ�������Һ��ͨ������Ķ�����̼���壬�����ó������ˡ�ϴ�ӡ���ɡ����գ��õ�����������Ϊm1 g������Ʒ���Ͻ���þ����������Ϊ_____________��
53����ͬѧȡ��Ʒ��m2 g�����������ᷴӦ��Ȼ��μӹ���������������Һ�����������ˡ�ϴ�ӡ���ɡ����գ��õ�����������Ϊm2 g������Ʒ���Ͻ���þ����������Ϊ____________��
54����ͬѧȡ��Ʒ��m3 g��������ϡ���ᷴӦ�����ֹ�����ȫ�ܽ⣬��״���µõ��������ΪV L������Ʒ����m3��ȡֵ��Χ��___________________________________________��
��ͬѧȡ��ͬ��������Ʒ���ֱ��30 mLͬŨ�ȵ����ᷴӦ����ȡ�Ͻ���������������������ת��Ϊ��״����������
ʵ����� | a | b | c |
�Ͻ�����/mg | 510 | 765 | 918 |
�������/mL | 560 | 672 | 672 |
55��ͨ������������������ʵ���Ũ�ȡ�
56��ͨ����������Ʒ���кϽ���þ������������
57����c��ʵ������������м���1.0 mol��L-1������������Һ���ٺ�������ʹʣ��Ͻ��е���ǡ����ȫ�ܽ���
52. 47.06%������2����
53. 60%������2����
54. 0.80V��m��1.07V
��2�����������27V/33.6��m��24V/22.4��9V/11.2��m��3V/2.8��������
55. �������ᷴӦ��ȫ��n(H2)=0.672/22.4 =0.03 mol����1����
��c(HCl)=0.03��2/0.03=2.0 mol��L-1��1����
56. ��Ͻ���Mg��Al�����ʵ����ֱ�Ϊx��y�����У�
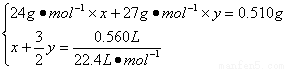
��1����
������x = y = 0.01 mol��1����
��w(Mg)=[(0.01 mol��24 g��mol-1)/0.510 g]��100%=47.06%��1����
57. ����HCl ~ NaCl��Al ~ NaAlO2��֪
n(NaCl)=n(HCl)=2.0 mol��L-1��0.030 L=0.06 mol��1�֣�
n(NaAlO2)=n(Al)=0.01 mol��918/510=0.018 mol��1����
����Na+�غ����n(NaOH)=0.06 mol+0.018 mol=0.078 mol��1����
��V(NaOH)=0.078 mol/1.0 mol��L-1=0.078 L=78 mL ��1����
��c��ʵ��������78 mL������������Һ������ʹʣ��Ͻ��е���ǡ����ȫ�ܽ⡣
��������
���������52.þ���Ͻ��������������Ʒ�Ӧ���ᆳ��������̼��Ӧ���ó������ˡ�ϴ�ӡ���ɡ����գ��õ�����Ϊ����������ӦǰΪþ����Ӧ��Ϊ���������������䣬����Ԫ���غ��֪����������������������Ϊþ������������Ϊ16��3/��16��3+27��2��= 47.06%��53.�÷�Ӧ�õ��Ĺ���Ϊ����þ������Ԫ�������غ㣬����þ��þԪ�ص�������������þ���Ͻ���þԪ�ص�����������Ϊ24/��24+16��= 60%��
54.þ����ϡ���ᷴӦ���ĵ����ͬ������������Ҳ��ͬ���ʲ��ü�ֵ��ȷ���䷶Χ������ȫΪþʱ
��������ΪV/22.4��24=1.07V������ȫΪ��ʱV/22.4��2/3��27=0.80V,��Χ0.80V��m��1.07V��
55.��ͬѧʵ���������������̶���bc�����ᷴӦ��ȫ��a�������Ӧ��ȫ���ʼ��������Ũ�ȸ���bc����������ֱ�ӵó����������ᷴӦ��ȫ��n(H2)=0.672/22.4 =0.03 mol��
��c(HCl)=0.03��2/0.03=2.0 mol��L-1
56.����a�������з���ʽ�ɽ⣬�ⷨ���𰸣�57.����Ԫ���غ㣬�Ͻ��������ձ�ΪNaAlO2����ʼ������������ձ�Ϊ�Ȼ��ƣ��˿ɳ�Ϊ��̬��������
n(NaCl)=n(HCl)=2.0 mol��L-1��0.030 L=0.06 mol����ԭ���غ㣩
n(NaAlO2)=n(Al)=0.01 mol��918/510=0.018 mol����ԭ���غ���
����Na+�غ����n(NaOH)=0.06 mol+0.018 mol=0.078 mol
��V(NaOH)=0.078 mol/1.0 mol��L-1=0.078 L=78 mL ��1����
��c��ʵ��������78 mL������������Һ������ʹʣ��Ͻ��е���ǡ����ȫ�ܽ⡣
���㣺������ѧ�����й����⡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�߶���ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������������ȷ����
A��ͬһ����Ԫ�ص���̬�⻯�����Է�������Խ��Ӧ���ۡ��е�һ��Խ��
B�������¶ȿɼӿ췴Ӧ���ʣ�����Ҫԭ���Ƿ�Ӧ������������ӣ���λ�������ӵ���Ŀ���࣬����ӵİٷ������䣬ʹ����Ч��ײ��������
C����R2�����Ӻ�M+���ӵĵ��Ӳ�ṹ��ͬ����ԭ��������R��M
D��������HA������ǿ������HB����ͬŨ��������Һ��pH��NaA��NaB
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ʯ��ʯī��̼Ԫ�ص����ֽṹ��ͬ�ĵ��ʣ�ͬ�������壩����100kPaʱ��1molʯīת��Ϊ���ʯ��Ҫ����1.895kJ�����ܡ��ݴˣ����ж���100kPaѹǿ�£����н�����ȷ����
A��ʯī�Ƚ��ʯ�ȶ�
B�����ʯ��ʯī�ȶ�
C��1molʯī��1mol���ʯ����������
D��1molʯī��1mol���ʯ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��ͨ�б�ҵ����ϰͳһ��������ۺϻ�ѧ�Ծ��������棩 ���ͣ������
��15�֣�X��Y��Z��W��R��TΪǰ������Ԫ����ԭ��������������Tԭ����������X��Y��Rԭ������֮�͡�ZΪ�ؿ��к�������Ԫ�ء�X��Zԭ�Ӻ������2��δ�ɶԵ��ӡ�Z��Rλ��ͬһ���塣X��Y��Z��W��R��T��ֻ�����ֽ���Ԫ�أ��Ҵ������з�Ӧ�� 2W+XZ2  X+2WZ
X+2WZ
�ش��������⣺
��1��X��Y��Z�ĵ�һ������������ ����Ԫ�ط��ű�ʾ����
��2����Ԫ��R��Ԫ��Z�γɵij����������У����ڷǼ��Է��ӵ��� ���ѧʽ�����÷���������ԭ���� �ӻ���
��3����X��TԪ����ɵĵ�����һ�������� ������ţ���
A�����Ӿ��� B�����Ӿ��� C��ԭ�Ӿ��� D����������
��4����̬Tԭ�ӵĺ�������Ų�ʽΪ ��
��5��T+����NH3ͨ����λ�����Ϊ[T(NH3)n]+����������T+��4s�����4p���ͨ��sp�ӻ�����NH3�ṩ�ŵ��Ӷԡ��� [T(NH3)n]+��n= ���� [T(NH3)n]+��T+��n����ԭ�ӹ��ɵĿռ�ṹ�� �͡�
��6��������WZ��NaCl�ľ����ṹ����
���Ȼ��ƾ����ṹ����ͼ��ʾ����
����WZ�У������Ӻ������ӵ���λ����Ϊ ��
����֪WZ���ܶ�Ϊa g/cm3����WZ�о�������������Ӽ�ľ���Ϊ pm���ú�a����ʽ��ʾ������٤������ΪNA����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��ͨ�б�ҵ����ϰͳһ��������ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£����и���������ָ����Һ��һ���ܴ����������
A��0.1 mol��L-1 NaHSO4��Һ��K+��Fe2+��NO3-��Cl-
B��0.1 mol��L-1NaAlO2����Һ��K+��Na+��SO42-��CO32-
C����ɫ��Һ��Ba 2+��Na+��MnO4-��NO3-
D����ˮ�������c(OH��)=1.0��10-12 mol��L-1����Һ��NH4+��HCO3-��Na+��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�Ϻ��л�����������ģ��ѧ�Ծ��������棩 ���ͣ������
�����12�֣�
�����裨Si3N4����һ�������մɲ��ϣ�������ʯӢ�뽹̿�ڸ��µĵ������У�ͨ�����·�Ӧ�Ƶã�

29����ƽ��Ӧ�и����ʵĻ�ѧ������������������ת�Ʒ������Ŀ��
30���÷�Ӧ���������� ���仹ԭ������ ��
31��������Ӧ�����������仯ʾ��ͼ���£�����ͼ���������߱�ʾ�ڷ�Ӧ��ʹ�ô����������ı仯�����


32���÷�Ӧ��ƽ�ⳣ������ʽΪK�� �������¶ȣ���ƽ�ⳣ�� ��ѡ����������������С����������������
33������ѧ��Ӧ�����뷴Ӧʱ��Ĺ�ϵ����ͼ��ʾ��t2ʱ����v��ͻ�䡢v�� �����ԭ����
��t������仯������Ϊ ��t5ʱ����v����仯��v��С�仯��ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�Ϻ��л�����������ģ��ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Һ����Fe2+��Na+��Al3+��Ba2+��SO42-��NO3-��Cl-�е�4�����ӣ��������ӵ����ʵ�����Ϊ1mol���������Һ�м��������ϡ���ᣬ�����ݲ���������Һ������������䣨������ˮ�ĵ�������ӵ�ˮ�⣩������˵������ȷ����
A���������Һ�м��������ϡ�����KSCN��Һ����Һ��Ѫ��ɫ
B���������Һ�м��������ϡ���ᣬ�����������������ܱ�ɺ���ɫ
C������Һ�������������ǣ�Fe2+��Na+��SO42-��NO3-
D���������Һ�м���������NaOH��Һ����ַ�Ӧ���ˡ�ϴ�ӡ����գ���������
���������Ϊ72g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�Ϻ��о������ڶ�ѧ�ڸ߶�ѧҵˮƽ���Ի�ѧ�Ծ��������棩 ���ͣ�������
ij����M�����������ˮ�Ͼ���[M(OH)2?xH2O]��Na2CO3����ﹲ36.800g������������ˮ������MCO3�İ�ɫ�������������˳���ϴ����ɣ�������Ϊ9.850g��
47. �� 9.850g MCO3�������������أ��õ�7.650g MO���壬�����CO2����_______mol��
48����Һ�������ò��������壻�����������������Һ���ȣ������4.48L����(��״��)����Һ��OH‑�����ʵ���Ϊ_______mol��
49.M�����ԭ������Ϊ_________����ͨ������ȷ��M(OH)2?xH2O��x��ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�Ϻ��б�ɽ���߶��꼶��ѧѧ��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��ɫ��Һ����Na+��Fe3+��Cl-��SO42-�е�2���������ֱ�ȡ����Һ����������ʵ����
��1������Һ�еμ��������ữ��AgNO3��Һ���а�ɫ����������
��2������Һ�еμ�Ba(NO3)2��Һ��û���κ�����
��������ʵ��������ȷ����Һ��һ�����ڵ�������
A��Fe3+��Cl- B. Na+��SO42- C. Fe3+ ��SO42- D. Na+��Cl-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com