
科目:高中化学 来源: 题型:
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)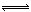 NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO(g)+Cl2(g)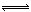 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g)+2NaCl(s)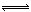 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d..向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应限度的说法中正确的是( )
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,正反应速率和逆反应速率相等,都等于0
C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变
D.化学反应的限度不可以通过改变 件而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 体积/mL | 50 | 120 | 250 | 306 | 336 |
下列说法正确的是:
A.0~1 min反应速率最大,因为此时反应物浓度最高
B.2~3min反应速率最大,因为此时反应物浓度相对较高,且反应放热使温度升高
C.3~4 min时间内以盐酸的浓度变化来表示的平均反应速率为0.5mol·L-1 ·min-1
D.4~5min反应速率最大,因为此时反应混合物的温度最高
查看答案和解析>>
科目:高中化学 来源: 题型:
测定中和热实验装置如图:

(1)若实验测得稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol
①下列说法正确的是:_____________
A、稀盐酸和稀 NaOH溶液反应的中和热为 -57.3kJ/mol
B、稀硫酸与稀NaOH溶液反应的中和热为 -57.3kJ/mol
C、 浓硫酸与稀NaOH溶液反应的中和热为 -57.3kJ/mol
D、稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
②若将NaOH溶液换成Ba(OH)2溶液,经测定向足量的稀硫酸溶液中加入100mL0.4mol/L Ba(OH)2溶液,放出热量5.12kJ,试通过计算分析此实验中导致中和热变化的原因:______________
(2)取50mL0.5mol/LNaOH溶液和30mL0.5mol/L稀硫酸进行实验,结果如下表所示:

如果近似认为两种溶液的密度都是1g/cm3,中和后生成的溶液比热容c=4.18J/(g·oC),则中和热 H=__________kJ/mol(小数点后保留1位)。上述实验结果的数值与57.3 kJ/mol 有偏差,产生偏差的原因可能是(填字母)________________
H=__________kJ/mol(小数点后保留1位)。上述实验结果的数值与57.3 kJ/mol 有偏差,产生偏差的原因可能是(填字母)________________
A .实验装置保温隔热效果差
B .在量取Na0H 溶液的体积时仰视读数
C .分多次把NaOH 溶液倒人盛有硫酸的小烧杯中
D .用温度计测定Na0H 溶液的起始温度后直接测定H2S04 溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.氟氯烃是一类含氟和氯原子的卤代烃
B.1-丁烯存在顺反异构
C.1 mol甲烷可与2 molCl2完全取代生成CCl4
D. 的结构中含有决定醇类性质的官能团——羟基
的结构中含有决定醇类性质的官能团——羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇和乙酸是比较常见的有机物。
(1)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为________________(不用写反应条件),原子利用率是__________。
(2)乙醇能够发生氧化反应:
乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为________________________________________________________________________。
(3)下列关于乙醇的说法正确的是__________(选填字母)。
A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应
B.交警用橙色的酸性重铬酸钾溶液检查司机是否酒后驾车
C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了
(4)做菜时既加醋又加酒可以增加菜的香味,其原因是生成了酯类物质,写出该反应的化学方程式__________________________,该反应的反应类型为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用于制造隐形飞机的物质A 具有吸收微波的功能,其主要成分
的结构如图,关于该物质的说法正确的是
A.该物质属于高聚物,也是一种烯烃
B.1mol该物质最多可与2molH2发生加成反应
C.该物质不可能使溴水褪色
D.该物质完全燃烧为CO2和H2O的物质的量之比为3:1

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com