
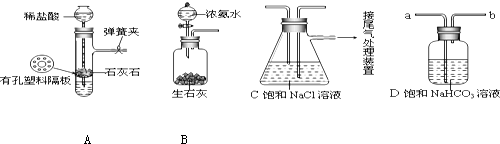
分析 (1)注入一定量的水后,试管内气体被压缩管内压强增大,使得出现液面差;液面差保持不变时,说明装置不漏气;
(2)为使气体通过溶液,气体从a通入溶液,混在气体中的HCl与溶液中的碳酸氢钠反应而被吸收;换做碳酸钠溶液,二氧化碳气体被碳酸钠溶液吸收;
(3)实验时先向饱和NaCl溶液中通入气体的先后顺序是先向饱和NaCl溶液中通入较多的氨气,再通入足量的二氧化碳;
(4)还需发生的反应是2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
解答 解:候氏制碱法是用二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体,反应的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(1)随水的注入管内加压增大,漏斗内液体不能再流入试管,使长颈漏斗与管内液面出现液面差,并且液面差保持不变,说明装置气密性良好;
故答案为:长颈漏斗中注入水,漏斗中与试管中的液(水)面差保持不再变化或漏斗中的液(水)面不再下降;
(2)装置D内盛放的碳酸氢钠溶液能与混在气体中的HCl发生反应生成氯化钠、水和二氧化碳,从而除去混在气体中的HCl;
故答案为:HCl;
(3)实验时先向饱和NaCl溶液中通入气体的先后顺序是先向饱和NaCl溶液中通入较多的NH3,再通入足量的CO2;
故答案为:先向饱和NaCl溶液中通入较多的NH3,再通入足量的CO2;
(4)如果制得纯碱需要对碳酸氢钠固体加热分解得到,反应化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
点评 本题考查了利用工业制碱原理,设计实验室制取碳酸钠的实验方案分析判断,根据装置中的药品的性质及装置的连接方式,是准确判断或理解装置作用的一种有效方法.


科目:高中化学 来源: 题型:实验题
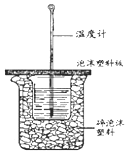 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 20.0 | 30.0 | 40.0 |
| 平衡时气体总浓度 (×10-3mol•L-1) | 3.4 | 4.8 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| B. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量 Cu(NO3)2溶液 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,降低温度时:v(正)增大,v (逆)减小,平衡时氢气转化率增大 | |
| D. | 吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反 应的△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去O2中混有的N2:选用灼热的铜网 | |
| B. | 提取碘水中的碘单质:选用有机试剂苯 | |
| C. | 除去CO2中混有的CO:选用适量澄清石灰水 | |
| D. | 除去Mg粉中混有的MgO:选用过量稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com