
【题目】下列实验操作和现象与所得结论一定正确的是
选项 | 操作 | 现象 | 结论 |
A | 向黄色的 | 溶液变为紫红色 | 氧化性: |
B | 向某无色溶液中滴加稀盐酸,将产生的无色气体通入品红溶液 | 品红溶液褪色 | 原溶液中含有 |
C | 向 | 得到白色沉淀 | 相同温度下,溶度积常数: |
D | 一定温度下,向 | 溶液橙色变浅 | 减小 |
A.AB.B C.CD.D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】烃A可以发生下列过程所示的变化:
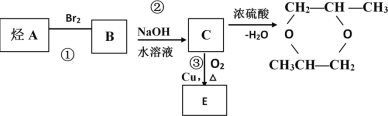
(1)烃A的结构简式是____________;
(2)反应①属_____________反应;
(3)反应②的化学方程式是________,属______反应;反应③的化学方程式是______,属_______反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几种有机物:①![]() ②
②![]() ③
③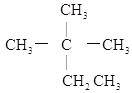 ④癸烷⑤
④癸烷⑤![]() ⑥
⑥![]() ⑦
⑦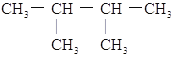 ⑧丙烷。请根据上述物质按要求回答下列问题。
⑧丙烷。请根据上述物质按要求回答下列问题。
(1)相对分子质量为44的烷烃的结构简式为________(填化学式)。
(2)与③互为同分异构体的是_______(填序号)。
(3)有机物②在加热条件下和![]() 反应的化学方程式为________。
反应的化学方程式为________。
(4)在120℃、![]() 条件下,某种气态烃与足量的
条件下,某种气态烃与足量的![]() ,完全反应后,测得反应前后气体的体积没有发生改变,则该烃是_______(填序号)。
,完全反应后,测得反应前后气体的体积没有发生改变,则该烃是_______(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下![]() 部分操作和条件略
部分操作和条件略![]() :
:
Ⅰ![]() 从废液中提纯并结晶出
从废液中提纯并结晶出![]()
Ⅱ![]() 将
将![]() 配制成溶液.
配制成溶液.
Ⅲ![]() 溶液与稍过量的
溶液与稍过量的![]() 溶液混合,得到含
溶液混合,得到含![]() 的浊液.
的浊液.
Ⅳ![]() 将浊液过滤,用
将浊液过滤,用![]() 热水洗涤沉淀,干燥后得到
热水洗涤沉淀,干燥后得到![]() 固体.
固体.
Ⅴ![]() 煅烧
煅烧![]() ,得到
,得到![]() 固体.
固体.
已知:![]() 在热水中分解.
在热水中分解.
![]() Ⅰ中,加足量的铁屑除去废液中的
Ⅰ中,加足量的铁屑除去废液中的![]() ,该反应的离子方程式是 ______ .
,该反应的离子方程式是 ______ .
![]() Ⅱ中,需加一定量酸,该酸最好是 ______
Ⅱ中,需加一定量酸,该酸最好是 ______ ![]() 运用化学平衡原理简述该酸的作用 ______ .
运用化学平衡原理简述该酸的作用 ______ .
![]() Ⅲ中,生成
Ⅲ中,生成![]() 的离子方程式是 ______
的离子方程式是 ______ ![]() 若
若![]() 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 ______ .
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 ______ .
![]() Ⅳ中,通过检验
Ⅳ中,通过检验![]() 来判断沉淀是否洗涤干净,检验
来判断沉淀是否洗涤干净,检验![]() 的操作是 ______ .
的操作是 ______ .
![]() 已知煅烧
已知煅烧![]() 的化学方程式是
的化学方程式是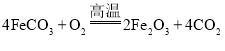 现煅烧
现煅烧![]() 的
的![]() ,得到
,得到![]() 产品.若产品中杂质只有FeO,则该产品中
产品.若产品中杂质只有FeO,则该产品中![]() 的质量是 ______
的质量是 ______ ![]() 摩尔质量
摩尔质量![]() :
:![]()
![]() 160FeO
160FeO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由C元素形成的单质,已知甲+乙=丁+己,甲+丙=戊+己,0.1mol·L-1丁溶液的pH为13(25℃)。下列说法正确的是
A. 原子半径:D>C >B>A
B. B元素只能形成一种二元含氧酸,且B元素的含氧酸对应的酸酐一定是氧化物
C. 1mol甲与足量乙反应转移电子的数目为NA
D. 1.0L 0.1mol·L-1戊溶液中阴离子总的物质的量小于0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是我国药学家屠呦呦在1971年发现的一种含有过氧基团的倍半萜内酯的无色针状晶体,不溶于水,易溶于乙醇、石油醚、苯等有机溶剂,熔点为156℃,沸点389.9℃,热稳定性差。一种超声提取青蒿素的主要工艺流程如图:
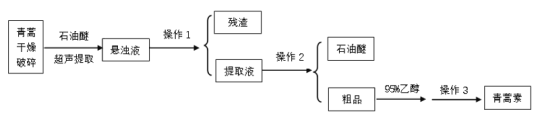
已知:石油醚的沸点为30~80℃,青蒿素在95%乙醇中的溶解度随温度的升高而增大。下列说法不正确的是( )
A.超声提取的原理是在强大的超声波作用下,使青蒿细胞乳化、击碎、扩散,其优点是加速溶解
B.操作1的名称是萃取
C.操作3的步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.操作3中若温度过高,会降低青蒿素的产率,其原因可能是青蒿素热稳定性差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工农业生产中具有广泛应用。
请回答下列问题:
(1)基态B原子的价电子排布图___,B属于元素周期表中的___区元素。
(2)NaBO2可用于织物漂白。
①第二周期中第一电离能介于B和O之间的元素为___(填元素符号)。
②BO2-的空间构型为____,写出两种与其互为等电子体的分子的化学式:____。
(3)BF3和F-可以形成BF4-,BF3和BF4-中B原子的杂化方式分别为_____、____。
(4)立方BN和立方AlN均为原子晶体,结构相似,BN的熔点高于AlN的原因为______。
(5)一种新型轻质储氢材料的晶胞结构如图所示:
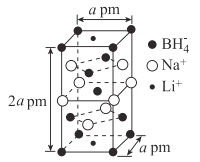
①该化合物的化学式为____。
②设阿伏加德罗常数的值为NA,该晶体的密度为___g·cm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有可逆反应.2NO2(g)![]() N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
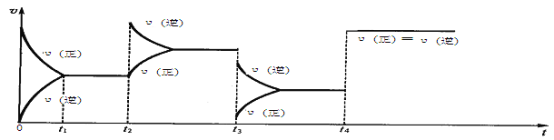
t2:_______________________________________________;
t3:_______________________________________________;
t4:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
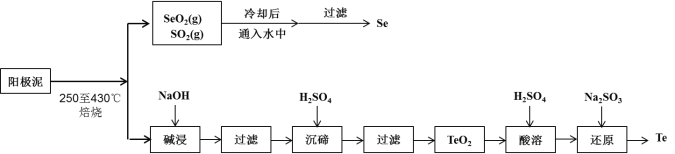
已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)Se在周期表中的位置为____________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有2 mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(3)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(4)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为_______________________________________。
(5)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是_______________________________________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),请通过计算说明_____________________________。(已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.5×10-7)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com