
ЎҫМвДҝЎҝТФё»ә¬БтЛбСЗМъөД№ӨТө·ПТәОӘФӯБПЙъІъСх»ҜМъөД№ӨТХИзПВ![]() Іҝ·ЦІЩЧчәНМхјюВФ
Іҝ·ЦІЩЧчәНМхјюВФ![]() Јә
Јә
ўс![]() ҙУ·ПТәЦРМбҙҝІўҪбҫ§іц
ҙУ·ПТәЦРМбҙҝІўҪбҫ§іц![]()
ўт![]() Ҫ«
Ҫ«![]() ЕдЦЖіЙИЬТәЈ®
ЕдЦЖіЙИЬТәЈ®
ўу![]() ИЬТәУлЙФ№эБҝөД
ИЬТәУлЙФ№эБҝөД![]() ИЬТә»мәПЈ¬өГөҪә¬
ИЬТә»мәПЈ¬өГөҪә¬![]() өДЧЗТәЈ®
өДЧЗТәЈ®
ўф![]() Ҫ«ЧЗТә№эВЛЈ¬УГ
Ҫ«ЧЗТә№эВЛЈ¬УГ![]() ИИЛ®ПҙөУіБөнЈ¬ёЙФпәуөГөҪ
ИИЛ®ПҙөУіБөнЈ¬ёЙФпәуөГөҪ![]() №ММеЈ®
№ММеЈ®
ўх![]() мСЙХ
мСЙХ![]() Ј¬өГөҪ
Ј¬өГөҪ![]() №ММеЈ®
№ММеЈ®
ТСЦӘЈә![]() ФЪИИЛ®ЦР·ЦҪвЈ®
ФЪИИЛ®ЦР·ЦҪвЈ®
![]() ўсЦРЈ¬јУЧгБҝөДМъРјіэИҘ·ПТәЦРөД
ўсЦРЈ¬јУЧгБҝөДМъРјіэИҘ·ПТәЦРөД![]() Ј¬ёГ·ҙУҰөДАлЧУ·ҪіМКҪКЗ ______ Ј®
Ј¬ёГ·ҙУҰөДАлЧУ·ҪіМКҪКЗ ______ Ј®
![]() ўтЦРЈ¬РијУТ»¶ЁБҝЛбЈ¬ёГЛбЧоәГКЗ ______
ўтЦРЈ¬РијУТ»¶ЁБҝЛбЈ¬ёГЛбЧоәГКЗ ______ ![]() ФЛУГ»ҜС§ЖҪәвФӯАнјтКцёГЛбөДЧчУГ ______ Ј®
ФЛУГ»ҜС§ЖҪәвФӯАнјтКцёГЛбөДЧчУГ ______ Ј®
![]() ўуЦРЈ¬ЙъіЙ
ўуЦРЈ¬ЙъіЙ![]() өДАлЧУ·ҪіМКҪКЗ ______
өДАлЧУ·ҪіМКҪКЗ ______ ![]() Иф
Иф![]() ЧЗТәіӨКұјдұ©В¶ФЪҝХЖшЦРЈ¬»бУРІҝ·Ц№ММеұнГжұдОӘәмәЦЙ«Ј¬ёГұд»ҜөД»ҜС§·ҪіМКҪКЗ ______ Ј®
ЧЗТәіӨКұјдұ©В¶ФЪҝХЖшЦРЈ¬»бУРІҝ·Ц№ММеұнГжұдОӘәмәЦЙ«Ј¬ёГұд»ҜөД»ҜС§·ҪіМКҪКЗ ______ Ј®
![]() ўфЦРЈ¬НЁ№эјмСй
ўфЦРЈ¬НЁ№эјмСй![]() АҙЕР¶ПіБөнКЗ·сПҙөУёЙҫ»Ј¬јмСй
АҙЕР¶ПіБөнКЗ·сПҙөУёЙҫ»Ј¬јмСй![]() өДІЩЧчКЗ ______ Ј®
өДІЩЧчКЗ ______ Ј®
![]() ТСЦӘмСЙХ
ТСЦӘмСЙХ![]() өД»ҜС§·ҪіМКҪКЗ
өД»ҜС§·ҪіМКҪКЗ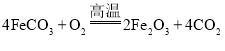 ПЦмСЙХ
ПЦмСЙХ![]() өД
өД![]() Ј¬өГөҪ
Ј¬өГөҪ![]() ІъЖ·Ј®ИфІъЖ·ЦРФУЦКЦ»УРFeOЈ¬ФтёГІъЖ·ЦР
ІъЖ·Ј®ИфІъЖ·ЦРФУЦКЦ»УРFeOЈ¬ФтёГІъЖ·ЦР![]() өДЦКБҝКЗ ______
өДЦКБҝКЗ ______ ![]() ДҰ¶ыЦКБҝ
ДҰ¶ыЦКБҝ![]() Јә
Јә![]()
![]() 160FeO
160FeO![]()
Ўҫҙр°ёЎҝ![]() БтЛб јУИлБтЛбЈ¬ФцҙуЗвАлЧУЕЁ¶ИЈ¬К№
БтЛб јУИлБтЛбЈ¬ФцҙуЗвАлЧУЕЁ¶ИЈ¬К№![]() өДЖҪәвПтЧуТЖ¶ҜЈ¬ҙУ¶шТЦЦЖ
өДЖҪәвПтЧуТЖ¶ҜЈ¬ҙУ¶шТЦЦЖ![]() өДЛ®Ҫв
өДЛ®Ҫв ![]()
![]() ИЎЙЩБҝПҙөУәуөДИЬТәУЪКФ№ЬЦРЈ¬өОјУСОЛбЛб»ҜөДВИ»ҜұөИЬТәЈ¬ИфОЮ°ЧЙ«іБөнЙъіЙЈ¬ФтЛөГчіБөнПҙөУёЙҫ»
ИЎЙЩБҝПҙөУәуөДИЬТәУЪКФ№ЬЦРЈ¬өОјУСОЛбЛб»ҜөДВИ»ҜұөИЬТәЈ¬ИфОЮ°ЧЙ«іБөнЙъіЙЈ¬ФтЛөГчіБөнПҙөУёЙҫ» ![]()
ЎҫҪвОцЎҝ
(1)FeҝЙТФәНИэјЫМъ·ҙУҰЙъіЙСЗМъАлЧУЈ»
(2)FeSO47H2OЕдЦЖіЙИЬТәөД№эіМЦРЈ¬СЗМъАлЧУТЧЛ®ҪвЈ¬ёщҫЭЖҪәвТЖ¶ҜФӯАнАҙ·ЦОцЈ»
(3)СЗМъАлЧУәНМјЛбЗвёщАлЧУПа»ҘҙЩҪшЛ®ҪвЙъіЙМјЛбСЗМъәН¶юСх»ҜМјЈ¬СЗМъАлЧУТЧұ»СхЖшСх»ҜОӘИэјЫМъЈ»
(4)ёщҫЭБтЛбёщАлЧУҝЙТФәНұөАлЧУ·ҙУҰЙъіЙІ»ИЬУЪПхЛбөД°ЧЙ«іБөнАҙјмСйБтЛбёщАлЧУЈ»
(5)мСЙХFeCO3ҝЙЙъіЙСх»ҜМъәН¶юСх»ҜМјЈ¬ёщҫЭә¬МъФӘЛШОпЦКөДЦКБҝ№ШПөАҙјЖЛгЎЈ
![]() МъРјУл
МъРјУл![]() ·ўЙъСх»Ҝ»№Фӯ·ҙУҰЈ¬АлЧУ·ҪіМКҪОӘЈә
·ўЙъСх»Ҝ»№Фӯ·ҙУҰЈ¬АлЧУ·ҪіМКҪОӘЈә![]() Ј»
Ј»
![]() »сөГ
»сөГ![]() ИЬТәЈ¬№КЧоәГСЎУГБтЛбЈ¬І»»бТэИлРВөДФУЦКЈ»јУИлБтЛбЈ¬ФцҙуЗвАлЧУЕЁ¶ИЈ¬К№
ИЬТәЈ¬№КЧоәГСЎУГБтЛбЈ¬І»»бТэИлРВөДФУЦКЈ»јУИлБтЛбЈ¬ФцҙуЗвАлЧУЕЁ¶ИЈ¬К№![]() өДЖҪәвПтЧуТЖ¶ҜЈ¬ҙУ¶шТЦЦЖ
өДЖҪәвПтЧуТЖ¶ҜЈ¬ҙУ¶шТЦЦЖ![]() өДЛ®ҪвЈ»
өДЛ®ҪвЈ»
![]() ИЬТәУл
ИЬТәУл![]() ИЬТә·ҙУҰЙъіЙ
ИЬТә·ҙУҰЙъіЙ![]() өД·ҪіМКҪОӘЈә
өД·ҪіМКҪОӘЈә![]() Ј¬
Ј¬![]() јЫөДМъҫЯУР»№ФӯРФЈ¬№КF
јЫөДМъҫЯУР»№ФӯРФЈ¬№КF![]() ЧЗТәФЪҝХЖшЦРИЭТЧұ»Сх»ҜЙъіЙЗвСх»ҜМъЈ¬·ҪіМКҪОӘЈә
ЧЗТәФЪҝХЖшЦРИЭТЧұ»Сх»ҜЙъіЙЗвСх»ҜМъЈ¬·ҪіМКҪОӘЈә![]() Ј»
Ј»
![]() јмСйБтЛбёщАлЧУөД·Ҫ·ЁКЗЈәИЎЙЩБҝПҙөУәуөДИЬТәУЪКФ№ЬЦРЈ¬өОјУСОЛбЛб»ҜөДВИ»ҜұөИЬТәЈ¬ИфОЮ°ЧЙ«іБөнЙъіЙЈ¬ФтЛөГчіБөнПҙөУёЙҫ»Ј»
јмСйБтЛбёщАлЧУөД·Ҫ·ЁКЗЈәИЎЙЩБҝПҙөУәуөДИЬТәУЪКФ№ЬЦРЈ¬өОјУСОЛбЛб»ҜөДВИ»ҜұөИЬТәЈ¬ИфОЮ°ЧЙ«іБөнЙъіЙЈ¬ФтЛөГчіБөнПҙөУёЙҫ»Ј»
![]() өД
өД![]() өДОпЦКөДБҝОӘ
өДОпЦКөДБҝОӘ![]() Ј¬Йи
Ј¬Йи![]() өДОпЦКөДБҝОӘxkmolЈ¬FeOөДОпЦКөДБҝОӘykmolЈ¬ёщҫЭМъКШәгәН»мәПОпөДЦКБҝҝЙЦӘ
өДОпЦКөДБҝОӘxkmolЈ¬FeOөДОпЦКөДБҝОӘykmolЈ¬ёщҫЭМъКШәгәН»мәПОпөДЦКБҝҝЙЦӘ![]() Ј¬
Ј¬![]() Ј¬ҪвөГЈә
Ј¬ҪвөГЈә![]() Ј¬№КF
Ј¬№КF![]() өДЦКБҝОӘЈә
өДЦКБҝОӘЈә![]() ЎЈ
ЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУГПВБРКөСйЧ°ЦГҪшРРПаУҰКөСйДЬҙпөҪКөСйДҝөДөДКЗЈЁ Ј©
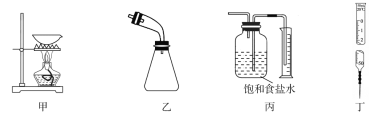
A.УГјЧЧ°ЦГҙУKIәНI2өД№ММе»мәПОпЦР»ШКХI2
B.УГТТЧ°ЦГҪУКХКҜУН·ЦБуКөСйЦРЛщөГөДБу·Ц
C.УГұыЧ°ЦГІвБҝУГMnO2әНЕЁСОЛб№ІИИЦЖөГөДCl2Ме»э
D.УГ¶ЎЧ°ЦГЧјИ·БҝИЎТ»¶ЁМе»эөДKMnO4ұкЧјИЬТә
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝХэИ·ұнКҫПВБР·ҙУҰөДАлЧУ·ҙУҰ·ҪіМКҪОӘ
A.ПтFeBr2ИЬТәЦРНЁИлЧгБҝВИЖшЈә2Fe2++4Br©Ғ+3Cl2ЁT2 Fe3++2 Br2+6Cl©Ғ
B.ПтГч·ҜИЬТәЦРөОјУBaЈЁOHЈ©2ИЬТәЈ¬ЗЎәГК№SO42©ҒіБөнНкИ«Јә![]()
C.![]() ПЎИЬТәУл№эБҝөДKOHИЬТә·ҙУҰЈә
ПЎИЬТәУл№эБҝөДKOHИЬТә·ҙУҰЈә![]()
D.ҙЧЛбіэИҘЛ®№ёЈә![]()
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝоСЛбёЖ(CaTiO3)ІДБПЦЖұёФӯАнЦ®Т»КЗCaCO3Ј«TiO2![]() CaTiO3Ј«CO2ЎьЎЈПВБРУР№ШЕР¶ПІ»ХэИ·өДКЗ(ЎЎЎЎ)
CaTiO3Ј«CO2ЎьЎЈПВБРУР№ШЕР¶ПІ»ХэИ·өДКЗ(ЎЎЎЎ)
A.TiO2КЗҪрКфСх»ҜОпЈ¬ЛщТФІ»КЗЛбРФСх»ҜОп
B.CaCO3ЎўCaTiO3ҫщКфУЪә¬СхЛбСО
C.CaCO3ДСИЬУЪЛ®Ј¬КфУЪЗҝөзҪвЦК
D.ЙПКц·ҙУҰІ»КЗСх»Ҝ»№Фӯ·ҙУҰ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ»ҜС§УлЙъ»оГЬЗРПа№ШЎЈПВБРЛө·ЁҙнОуөДКЗ
A. PM2.5КЗЦёБЈҫ¶І»ҙуУЪ2.5ҰМmөДҝЙОьИлРьёЎҝЕБЈОп
B. ВМЙ«»ҜС§ТӘЗуҙУФҙН·ЙППыіэ»тјхЙЩЙъІъ»о¶Ҝ¶Ф»·ҫіөДОЫИҫ
C. ИјГәЦРјУИлCaOҝЙТФјхЙЩЛбУкөДРОіЙј°ОВКТЖшМеөДЕЕ·Е
D. МмИ»ЖшәНТә»ҜКҜУНЖшКЗОТ№ъДҝЗ°НЖ№гК№УГөДЗеҪаИјБП
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝСРҫҝ·ўПЦЈ¬ҝЙТФУГКҜД«ЧчСфј«ЎўоСНшЧчТхј«ЎўИЫИЪCaF2ЎӘCaOЧчөзҪвЦКЈ¬АыУГНјКҫЧ°ЦГ»сөГҪрКфёЖЈ¬ІўТФёЖОӘ»№ФӯјБ»№Фӯ¶юСх»ҜоСЦЖұёҪрКфоСЎЈПВБРЛө·ЁЦРІ»ХэИ·өДКЗЈЁ Ј©
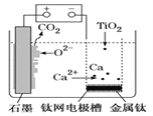
A.УЙTiO2ЦЖөГ1molҪрКфTiЈ¬АнВЫЙПНвөзВ·ЧӘТЖ4molөзЧУ
B.Сфј«өДөзј«·ҙУҰКҪОӘC+2O2-Јӯ4e-=CO2Ўь
C.ФЪЦЖұёҪрКфоСЗ°әуЈ¬ХыМЧЧ°ЦГЦРCaOөДЧЬБҝ»бІ»¶ПјхЙЩ
D.Ч°ЦГЦРКҜД«өзј«ІДБПРиТӘ¶ЁЖЪёь»»
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРКөСйІЩЧчәНПЦПуУлЛщөГҪбВЫТ»¶ЁХэИ·өДКЗ
СЎПо | ІЩЧч | ПЦПу | ҪбВЫ |
A | Пт»ЖЙ«өД | ИЬТәұдОӘЧПәмЙ« | Сх»ҜРФЈә |
B | ПтДіОЮЙ«ИЬТәЦРөОјУПЎСОЛбЈ¬Ҫ«ІъЙъөДОЮЙ«ЖшМеНЁИлЖ·әмИЬТә | Ж·әмИЬТәНКЙ« | ФӯИЬТәЦРә¬УР |
C | Пт | өГөҪ°ЧЙ«іБөн | ПаН¬ОВ¶ИПВЈ¬ИЬ¶И»эіЈКэЈә |
D | Т»¶ЁОВ¶ИПВЈ¬Пт | ИЬТәіИЙ«ұдЗі | јхРЎ |
A.AB.B C.CD.D
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪТ»ГЬұХИЭЖчЦРідИл1 mol H2әН1 mol I2Ј¬С№ЗҝОӘp(Pa)Ј¬ІўФЪТ»¶ЁОВ¶ИПВК№Жд·ўЙъ·ҙУҰ:H2(g)+I2(g) ![]() 2HI(g)
2HI(g)
(1)ұЈіЦИЭЖчИЭ»эІ»ұдЈ¬ПтЖдЦРідИл1 mol H2Ј¬·ҙУҰЛЩВК_____ЈЁМоЎ°ФцҙуЎұЎўЎ°јхРЎЎұ»тЎ°І»ұдЎұЈ¬ПВН¬Ј©ЎЈ
(2)ЙэёЯОВ¶ИЈ¬·ҙУҰЛЩВК_____ЎЈ
(3)А©ҙуИЭЖчМе»эЈ¬·ҙУҰЛЩВК_____ЎЈ
(4)ұЈіЦИЭЖчДЪЖшМеС№ЗҝІ»ұдЈ¬ПтЖдЦРідИл1 mol H2(g)әН1 mol I2(g)Ј¬·ҙУҰЛЩВК_____ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝҪ«7gМъ·ЫН¶Ил400mL1mol/LHNO3ИЬТәЦРЈ¬»№ФӯІъОпОӘNOЎЈИф·ҙУҰәуИЬТәөДМе»эІ»ұдЈ¬ПВБРЛө·ЁҙнОуөДКЗЈЁ Ј©
A.ЙъіЙЖшМеФЪұкЧјЧҙҝцПВОӘ2.24L
B.·ҙУҰәуИЬТәЦРc(Fe3+)=0.125mol/L
C.·ҙУҰәуөДИЬТәФЩН¶Ил2.8gМъ·ЫҝЙИ«ІҝИЬҪв
D.·ҙУҰәуИЬТәЦРc(NO3-)=0.75mol/L
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com